2022-2023學(xué)年廣東省廣州五中高二(下)期中化學(xué)試卷
發(fā)布:2025/1/6 5:30:2
一、單選題(每題只有1個(gè)答案,1-10題2分/題,11-16題4分/題,共44分)
-
1.下列說法正確的是( )
A.原子光譜是由基態(tài)原子吸收能量到激發(fā)態(tài)時(shí),電子躍遷產(chǎn)生的 B.熔點(diǎn):金剛石>純鐵>生鐵>干冰 C.某元素基態(tài)原子的最外層電子排布式為4s2,則該元素為ⅡA族元素 D.鍵長H-F<H-Cl<H-Br<H-I,因此穩(wěn)定性HF<HCl<HBr<HI 組卷:4引用:1難度:0.5 -
2.下列各組晶體物質(zhì)中,化學(xué)鍵類型相同,晶體類型也相同的是( )
①SiO2和SO3
②晶體硼和HCl
③CO2和SO2
④晶體硅和金剛石
⑤晶體氖和晶體氮
⑥CH4和H2OA.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤ 組卷:11引用:1難度:0.7 -
3.下列關(guān)于丙烯(CH3CH=CH2)分子的說法中,錯(cuò)誤的是( )
A.有8個(gè)σ鍵,1個(gè)π鍵 B.有2個(gè)碳原子是sp2雜化 C.3個(gè)碳原子在同一平面上 D.所有原子都在同一平面上 組卷:271引用:5難度:0.7 -
4.關(guān)于化學(xué)式為[TiCl(H2O)5]Cl2?H2O的配合物,下列說法中正確的是( )
A.配位體是Cl-和H2O,配位數(shù)是8 B.中心離子是Ti4+,配離子是[TiCl(H2O)5]2+ C.內(nèi)界和外界中的Cl-的數(shù)目比是1:2 D.若往1mol該配合物中加入足量硝酸酸化的AgNO3溶液,可得到3molAgCl沉淀 組卷:20引用:1難度:0.6 -
5.關(guān)于CH3OH、N2H4和(CH3)2NNH2的結(jié)構(gòu)與性質(zhì),下列說法錯(cuò)誤的是( )
A.CH3OH為極性分子 B.CH3OH和(CH3)2NNH2中C、O、N雜化方式均相同 C.N2H4空間結(jié)構(gòu)為平面形 D.N2H4的沸點(diǎn)高于(CH3)2NNH2 組卷:20引用:1難度:0.7 -
6.如表中各粒子對應(yīng)的空間結(jié)構(gòu)及解釋均正確的是( )
選項(xiàng) 粒子 空間結(jié)構(gòu) 解釋 A 氨基負(fù)離子( )NH-2直線形 N原子采用sp雜化 B 甲醛(HCHO) 平面三角形 C原子采用sp3雜化 C 碳酸根離子( )CO2-3三角錐形 C原子采用sp3雜化 D 二氧化硫(SO2) V形 S原子采用sp2雜化 A.A B.B C.C D.D 組卷:45引用:4難度:0.5
二.非選擇題(17-20題,共4題,每題14分,共66分)
-
19.很多含巰基(-SH)的有機(jī)化合物是重金屬元素汞的解毒劑。例如,解毒劑化合物I可與氧化汞生成化合物II。

(1)基態(tài)硫原子價(jià)層電子排布式為。
(2)H2S、CH4、H2O的沸點(diǎn)由高到低順序?yàn)?。
(3)汞的原子序數(shù)為80,位于元素周期表第周期第IIB族。
(4)化合物Ⅲ也是一種汞解毒劑。化合物Ⅳ是一種強(qiáng)酸。下列說法正確的有。
A.在Ⅰ中S原子采取sp3雜化
B.在Ⅱ中S元素的電負(fù)性最大
C.在Ⅲ中C-C-C鍵角是180°
D.在Ⅲ中存在離子鍵與共價(jià)鍵
E.在Ⅳ中硫氧鍵的鍵能均相等
(5)汞解毒劑的水溶性好,有利于體內(nèi)重金屬元素汞的解毒。化合物Ⅰ與化合物Ⅲ相比,水溶性較好的是。
(6)理論計(jì)算預(yù)測,由汞(Hg)、鍺(Ge)、銻(Sb)形成的一種新物質(zhì)X為潛在的拓?fù)浣^緣體材料。X的晶體可視為Ge晶體(晶胞如圖a所示)中部分Ge原子被Hg和Sb取代后形成。
①圖b為Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一種單元結(jié)構(gòu),它不是晶胞單元,理由是。
②圖c為X的晶胞,X的晶體中與Hg距離最近的Sb的數(shù)目為;該晶胞中粒子個(gè)數(shù)比Hg:Ge:Sb=。
③設(shè)X的最簡式的式量為Mr,則X晶體的密度為g/cm3(列出算式)。組卷:31引用:1難度:0.4 -
20.鈣鈦礦(CaTiO3)型化合物是一類可用于生產(chǎn)太陽能電池、傳感器、固體電阻器等的功能材料。回答下列問題:
(1)基態(tài)Ti原子的核外電子排布式為,鈦在周期表中的位置。
(2)Ti的四鹵化物熔點(diǎn)如表所示,TiF4熔點(diǎn)高于其他三種鹵化物,自TiCl4至TiI4熔點(diǎn)依次升高,原因是。
(3)CaTiO3的晶胞如圖(a)所示,其組成元素的電負(fù)性由大到小的順序是化合物 TiF4 TiCl4 TiBr4 TiI4 熔點(diǎn)/℃ 377 -24.12 38.3 155 ;金屬離子與氧離子間的作用力為,Ca2+的配位數(shù)是。
(4)一種立方鈣鈦礦結(jié)構(gòu)的金屬鹵化物光電材料的組成為Pb2+、I-和有機(jī)堿離子CH3,其晶胞如圖(b)所示,其中Pb2+與圖(a)中NH+3的空間位置相同。有機(jī)堿CH3中,N原子的雜化軌道類型是NH+3。若晶胞參數(shù)為anm,則晶體密度為g?cm-3(列出計(jì)算式)。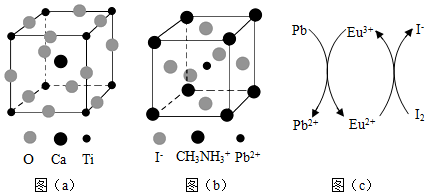
(5)用上述金屬鹵化物光電材料制作的太陽能電池在使用過程中會(huì)產(chǎn)生單質(zhì)鉛和碘,降低了器件效率和使用壽命。我國科學(xué)家巧妙地在此材料中引入稀土銪(Eu)鹽,提升了太陽能電池的效率和使用壽命,其作用原理如圖(c)所示,用離子方程式表示該原理、。組卷:21引用:2難度:0.5


