2019-2020學年吉林省長春一中高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、本題包括25個小題,每小題2分,共50分。每小題只有一個選項符合題意。
-
1.宣傳科學知識、介紹高科技、揭露偽科學是學習化學者的一種義務.下列各項中屬于偽科學的是( )
A.高溫高壓下將石墨制成金剛石 B.用良好的催化劑將水變成燃料油 C.將空氣中游離態的氮轉化為化合態 D.用復合材料代替人體某些關節 組卷:21引用:2難度:0.5 -
 2.圖1和圖2分別是1s電子的概率分布圖和電子云的輪廓圖。下列有關認識正確的是( )
2.圖1和圖2分別是1s電子的概率分布圖和電子云的輪廓圖。下列有關認識正確的是( )A.圖1中的每個小黑點表示1個電子 B.圖2表示1s電子只能在球體內出現 C.圖2表明1s電子云輪廓圖呈圓形,有無數對稱軸 D.圖1中的小黑點的疏密表示電子在核外空間某處單位體積內出現的機會的多少 組卷:11引用:1難度:0.6 -
3.某同學在學習核外電子排布的知識時,把15P原子的電子排布式寫成了1s22s22p63s23p2x3p1y,他違背了( )
A.能量守恒原理 B.泡利原理 C.能量最低原則 D.洪特規則 組卷:10引用:1難度:0.6 -
4.下列化合物中陽離子半徑與陰離子半徑比值最小的是( )
A.MgI2 B.KBr C.BaI2 D.NaF 組卷:26引用:2難度:0.4 -
5.下列各組元素按電負性大小排列正確的是( )
A.F>N>O B.O>Cl>F C.As>P>N D.Cl>S>As 組卷:8引用:4難度:0.5 -
6.下列離子中外層d 軌道達半充滿狀態的是( )
A.Cr3+ B.Fe3+ C.Co3+ D.Cu+ 組卷:79引用:5難度:0.8 -
7.下列各組分子中都屬于含極性鍵的非極性分子的是( )
A.CO2、H2S B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl 組卷:256引用:23難度:0.7 -
8.s軌道與s軌道重疊形成的共價鍵可用符號表示為σs-s,p軌道與p軌道以“頭碰頭”方式重疊形成的共價鍵可用符號表示為σp-p,請你指出下列分子中含有σs-sp鍵的是( )
A.N2 B.C2H4 C.C2H2 D.HCl 組卷:124引用:10難度:0.5 -
9.根據VSEPR模型判斷下列各組分子或離子結構相同的是( )
A.SO2和CO2 B.BF3和NH3 C.NH3和H2O D.CH4和NH4+ 組卷:19引用:1難度:0.9
二、解答題(共3小題,滿分50分)
-
27.Ⅰ.現有部分短周期元素的性質或原子結構如下表:
(1)元素T的原子次外層有元素編號 元素性質或原子結構 T M層上有2對成對電子 X 最外層電子數是次外層電子數的2倍 Y 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 Z 元素最高正價是+7價 種電子云伸展方向。元素X的一種同位素可測定文物年代,這種同位素的符號是。
(2)元素Y與氫元素形成一種離子YH4+,寫出該粒子的電子式(用元素符號表示)。
(3)元素Z與元素T相比,非金屬性較強的是(用元素符號表示),下列表述中能證明這一事實的是。
a.常溫下Z的單質和T的單質狀態不同
b.Z的氫化物比T的氫化物穩定
c.一定條件下Z和T的單質都能與氫氧化鈉溶液反應
(4)探尋物質的性質差異性是學習的重要方法之一。T、X、Y、Z四種元素的最高價氧化物的水化物中化學性質明顯不同于其他三種酸的是,理由是。
Ⅱ.金屬銅的導電性僅次于銀,居金屬中的第二位,大量用于電氣工業。
(5)請解釋金屬銅能導電的原因,Cu2+的價電子排布式為。
(6)向盛有硫酸銅水溶液的試管里加入氨水,首先形成藍色沉淀,繼續添加氨水,沉淀溶解,得到深藍色溶液,小心蒸發,最終得到深藍色的[Cu(NH3)4]SO4晶體,晶體中含有的化學鍵有、和。整個過程發生的化學反應有(用化學方程式表示)。組卷:1引用:1難度:0.5 -
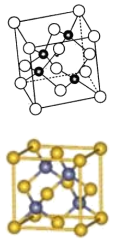 28.砷化鎵屬于第三代半導體,其晶胞結構如右圖所示,回答下列問題:
28.砷化鎵屬于第三代半導體,其晶胞結構如右圖所示,回答下列問題:
(1)下列說法中正確的是
A.電負性:As>Ga
B.第一電離能:As<Ga
C.砷和鎵都屬于p區元素
D.砷和鎵的晶胞結構與NaCl相同
E.半導體GaP、SiC與砷化鎵為等電子體
(2)砷化鎵是將(CH3)3Ga和AsH3用MOCVD方法制備得到,該反應在700℃進行,反應的化學方程式為。AsH3的空間構型為,(CH3)3Ga中鎵原子的雜化方式為。
(3)Ga的核外電子排布式為。
(4)AsH3的沸點比NH3,其原因是。
(5)砷化鎵晶體中最近的砷和鎵原子核間距為acm,砷化鎵的摩爾質量為bg/mol-1,阿伏加德羅常數值為NA,則砷化鎵晶體密度的表達式g/cm-3。
(6)60年代美國化學家鮑林提出了一個經驗規則:設含氧酸的化學式為HnROm,其中(m-n)為非羥基氧原子數,鮑林認為含氧酸的強弱與非羥基氧原子數(m-n)的關系見下表.
試回答下列問題:m-n 0 1 2 3 含氧酸強度 弱酸 中強 強 很強 實例 HClO H3PO4 HNO3 HClO4
①按此規則判斷H3AsO4、H2CrO4、HMnO4酸性由弱到強的順序為.
②H3PO3和H3AsO3的形式一樣,但酸性強弱相差很大.已知H3PO3為中強酸,H3AsO3為弱酸,試推斷H3PO3和H3AsO3的分子結構.
③按此規則判斷碳酸應屬于酸,與通常認為的碳酸的強度是否一致?.其可能的原因是.組卷:13引用:1難度:0.5


