2021-2022學年安徽省合肥六中高二(上)月考化學試卷
發(fā)布:2024/12/20 4:0:2
一、選擇題(每小題3分,共48分,每小題只有一個選項符合題意)
-
1.已知25℃時:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H1=-67.7kJ?mol-1
②H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ?mol-1
③Ba2+(aq)+(aq)═BaSO4(s)△H3<0SO2-4
下列說法正確的是( )A.HF的電離方程式及熱效應:HF(aq)═H+(aq)+F-(aq)△H>0 B.在氫氧化鈉溶液與鹽酸的反應中,鹽酸量一定,氫氧化鈉溶液量越多,中和熱越大 C.△H2=-57.3 kJ?mol-1是強酸和強堿在稀溶液中反應生成可溶鹽的中和熱 D.稀硫酸與稀氫氧化鋇溶液反應的熱化學方程式為:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 組卷:23引用:6難度:0.7 -
2.下列各選項中兩個反應的反應熱,其中△H1>△H2的是( )
A.2H2(g)+O2(g)═2H2O(g)△H1,;2H2(g)+O2(g)═2H2O(1)△H2 B.4P(g)+5O2(g)═2P2O5(g)△H1;4P(s)+5O2(g)═2P2O5(g)△H2 C.2SO2(g)+O2(g)?2SO3(g)△H1,;2SO3(g)?O2(g)+2SO2(g)△H2 D.已知反應:C(金剛石,s)═C(石墨,s)△H<0.C(金剛石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)
═CO2(g)△H2組卷:101引用:5難度:0.8 -
3.已知:
HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l)△H=-12.1KJ.mol-1;
HCl(aq )+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3KJ.mol-1;
則HCN在水溶液中電離的△H等于( )A.-69.4KJ.mol-1 B.-45.2KJ.mol-1 C.+45.2KJ.mol-1 D.+69.4KJ.mol-1 組卷:239引用:5難度:0.9 -
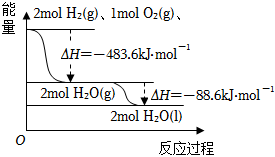 4.依據如圖判斷,下列說法正確的是( )
4.依據如圖判斷,下列說法正確的是( )A.氫氣的燃燒熱△H=-241.8 kJ?mol-1 B.2 mol H2(g)與1 mol O2(g)所具有的總能量比2 mol H2O(g) 所具有的總能量低 C.液態(tài)水分解的熱化學方程式為:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 D.H2O(g)生成H2O(l)時,斷鍵吸收的能量小于成鍵放出的能量 組卷:227引用:13難度:0.7 -
5.苯燃燒熱的熱化學方程式為C6H6(l)+
O2(g)=6CO2(g)+3H2O(l)△H=-3260kJ?mol-1,設阿伏加德羅常數的值為NA,下列說法正確的是( )152A.斷裂3NA個碳碳雙鍵時,放出3260kJ的熱量 B.消耗336L O2時,放出6520kJ的熱量 C.轉移30NA個電子時,放出3260kJ的熱量 D.生成3NA個氣態(tài)水分子時,放出3260kJ的熱量 組卷:72引用:3難度:0.9 -
6.已知各共價鍵的鍵能如下表所示,下列說法正確的是( )
共價鍵 H-H F-F H-F H-Cl H-I 鍵能E(kJ/mol) 436 157 568 432 298 A.鍵的極性:H-I>H-Cl>H-F B.表中最穩(wěn)定的共價鍵是F-F鍵 C.432kJ/mol>E(H-Br)>298kJ/mol D.H2(g)+F2(g)═2HF(g)ΔH=+25kJ/mol 組卷:108引用:4難度:0.8 -
7.下列有關化學反應速率的說法正確的是( )
A.用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以加快產生氫氣的速率 B.100mL 2mol?L-1的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變 C.SO2的催化氧化是一個放熱的反應,所以升高溫度,反應速率減慢 D.汽車尾氣中的NO和CO可以緩慢反應生成N2和CO2,減小壓強反應速率減慢 組卷:186引用:102難度:0.7
二、非選擇題(共52分)
-
20.如表是研究性學習小組研究影響過氧化氫(H2O2)分解速率的因素時采集的一組數據:用10mL H2O2溶液制取150mL氧氣所需的時間(單位:s)
請回答下列問題:
濃 度
反應條件30% H2O2 15% H2O2 10% H2O2 5% H2O2 無催化劑、不加熱 幾乎不反應 幾乎不反應 幾乎不反應 幾乎不反應 無催化劑、加 熱 360 480 540 720 MnO2催化劑、加熱 10 25 60 120
(1)該研究小組在設計方案時,考慮了濃度、、等反應條件對過氧化氫分解速率的影響.
(2)從上述影響過氧化氫分解速率的三個因素說明這些因素對分解速率有何影響?;;.組卷:38引用:6難度:0.5 -
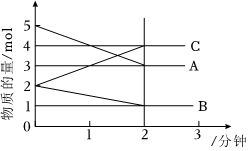 21.某反應在體積為5L的恒溫恒容密閉容器中進行,各物質的量隨時間的變化情況如圖所示(已知A、B、C均為氣體,A氣體有顏色)。
21.某反應在體積為5L的恒溫恒容密閉容器中進行,各物質的量隨時間的變化情況如圖所示(已知A、B、C均為氣體,A氣體有顏色)。
(1)該反應的化學方程式為。
(2)反應開始至2分鐘時,B的平均反應速率為。
(3)能說明該反應已達到平衡狀態(tài)的是。
A.容器內氣體的顏色保持不變
B.容器內氣體密度不變
C.v逆(A)=v正(C)
D.各組分的物質的量相等
E.混合氣體的平均相對分子質量不再改變的狀態(tài)
(4)由圖求得平衡時A的轉化率為。
(5)平衡時體系內的壓強是初始時倍。組卷:4引用:2難度:0.6


