2016-2017學年湖北省襄陽四中高二(下)第五周周練化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括24小題,每小題只有一個選項符合題意)
-
1.化學與生產和生活密切相關,下列過程中沒有發生化學變化的是( )
A.氯氣作水的殺菌消毒劑 B.硅膠作袋裝食品的干燥劑 C.二氧化硫作紙漿的漂白劑 D.肥皂水作蚊蟲叮咬處的清洗劑 組卷:1749引用:30難度:0.9 -
2.下列說法正確的是( )
A.1 mol NH3分子中含有3NA個σ鍵和4NA個sp3雜化軌道 B.1 mol CO2分子中含有2NA個σ鍵和2NA個sp2雜化軌道 C.1 mol C2H2分子中含有2NA個σ鍵、2NA個π鍵 D.1 mol C2H4分子中含有4NA個σ鍵、2NA個π鍵 組卷:3引用:1難度:0.5 -
3.分子式為C4H8Cl2的有機物共有( )(不含立體異構)
A.7種 B.8種 C.9種 D.10種 組卷:1891引用:68難度:0.9 -
4.對如圖兩種化合物的結構或性質描述正確的是( )
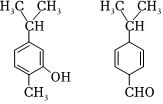
A.不是同分異構體 B.分子中共平面的碳原子數相同 C.可用紅外光譜區分,也能用核磁共振氫譜區分 D.可用紅外光譜區分,但不能用核磁共振氫譜區分 組卷:4引用:1難度:0.5 -
5.四聯苯
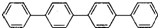 的一氯代物有( )
的一氯代物有( )A.3種 B.4種 C.5種 D.6種 組卷:5127引用:104難度:0.9 -
6.下列關于有機化合物的說法正確的是( )
A.2-甲基丁烷也稱異丁烷 B.由乙烯生成乙醇屬于加成反應 C.C4H9Cl有3種同分異構體 D.油脂和蛋白質都屬于高分子化合物 組卷:2454引用:34難度:0.9 -
7.軸烯是一類獨特的星形環烴。三元軸烯(
 )與苯( )
)與苯( )A.均為芳香烴 B.互為同素異形體 C.互為同系物 D.互為同分異構體 組卷:2548引用:35難度:0.5 -
8.硼的最高價含氧酸的化學式不可能是( )
A.HBO2 B.H2BO3 C.H3BO3 D.H2B4O7 組卷:256引用:10難度:0.9 -
9.下列各組物質的熔點均與所含化學鍵的鍵能有關的是( )
A.CaO與CO2 B.NaCl與HCl C.SiC與SiO2 D.Cl2與I2 組卷:692引用:19難度:0.9 -
10.烷烴
 的命名正確的是( )
的命名正確的是( )A.4-甲基-3-丙基戊烷 B.3-異丙基己烷 C.2-甲基-3-丙基戊烷 D.2-甲基-3-乙基己烷 組卷:1931引用:21難度:0.9
二、解答題(共6小題,滿分52分)
-
 29.部分弱酸的電離平衡常數如表。
29.部分弱酸的電離平衡常數如表。
(1)物質的量濃度均為0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是弱酸 HCOOH H2S H2SO3 電離平衡常數
(25℃)K=1.8×10-4 K1=9.1×10-8
K2=1.1×10-12K1=1.23×10-2
K2=6.6×10-8(填編號)
(2)設計實驗證明HCOOH為弱酸:。
(3)室溫下,下列溶液中水電離出的c(H+)水由大到小的順序為(填編號)。
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下電離:H2A=H++HA-,HA-?H++A2-,試回答下列問題:
①NaHA溶液呈(填“酸性”、“堿性”、“中性”)
②某溫度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此時溶液中以下關系一定正確的是
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)<c(Na+)
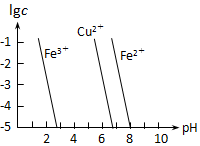
(5)如圖橫坐標為室溫下溶液的pH,縱坐標為金屬離子物質的量濃度的對數(當溶液中金屬離子濃度≤10-5mol/L時,可認為沉淀完全)。試回答:
①腐蝕銅 板的溶液中,若Cu2+、Fe3+、Fe2+濃度均為0.1mol/L,向混合溶液中通入氨氣調節溶液的pH=5.6時,溶液中存在的金屬陽離子為。
②從圖中的數據計算可得Fe(OH)2溶度積Ksp[Fe(OH)2]=。組卷:33引用:3難度:0.3 -
30.某常用的血液抗凝劑由(NH4)2C2O4和Na2C2O4組成,為確定其成分,某同學進行如下實驗:
①氮元素測定:精確稱取a g樣品,加適量蒸餾水溶解,注入如圖1所示的三頸瓶中,然后逐滴加入足量濃NaOH溶液,加熱裝置A產生水蒸氣,裝置B中產生的氨氣全部吹出,用V1mLc1mol/L的硫酸溶液吸收。蒸氨結束后取下接收瓶,用c2mol/LNaOH標準溶液滴定過剩的H2SO4,到終點時消耗V2mLNaOH溶液。
②C2O42-離子的測定:取實驗①B裝置中剩余溶液于錐形瓶中,先用稀硫酸酸化,再用0.1000mol/L的酸性KMnO4溶液滴定,終點時消耗酸性KMnO4溶液V3mL。
③計算:根據實驗①計算氮元素的含量,根據②計算C2O42-的含量,從而得到樣品中(NH4)2C2O4和Na2C2O4的比例。完成下列問題: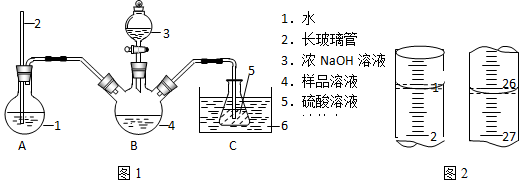
(1)裝置A中長玻璃管的作用是。
(2)用NaOH標準溶液滴定過剩H2SO4時,NaOH標準溶液盛裝在中(填儀器名稱)。
(3)樣品中氮元素的質量分數表達式為。
(4)實驗②中發生的離子方程式為。用酸性高錳酸鉀溶液滴定時終點現象為。
(5)實驗②中滴定開始和結束時,滴定管的讀數如圖2所示,則所用酸性KMnO4溶液體積V3=mL
(6)下列操作可能使實驗②測定結果偏低的是。
A.滴定管在注入溶液前用蒸餾水洗后未用標準溶液潤洗
B.開始時酸式滴定管尖嘴部分有氣泡,滴定過程中消失
C.滴定前仰視滴定管讀數,滴定后平視滴定管讀數。組卷:3引用:2難度:0.6


