2022-2023學年江蘇省鎮江市丹徒區共同體九年級(上)月考化學試卷(12月份)
發布:2024/10/31 18:30:3
一、單項選擇題(本題包括20,每小題2分,共40分。每小題只有1個選項符合題意)
-
1.下列屬于純凈物的是( )
A.葡萄糖 B.不銹鋼 C.赤鐵礦 D.石灰石 組卷:35引用:2難度:0.8 -
2.下列物質的用途主要與其化學性質有關的是( )
A.銅絲用作導線 B.金剛石切割玻璃 C.氯氣殺菌消毒 D.干冰用于制冷劑 組卷:31引用:3難度:0.9 -
3.下列符合“綠色、健康、舒適、安全”的生產生活理念的是( )
A.植樹造林,防沙降塵 B.禁用農藥,保護水源 C.回收垃圾,露天焚燒 D.煤氣泄漏,開燈查看 組卷:7引用:1難度:0.7 -
4.下列歸類正確的是( )
選項 歸類 物質 A 可燃性氣體 氫氣、氧氣、天然氣 B 人體微量元素 碘、鋅、硒、鐵等 C 能導電的金屬 鋁絲、石墨、鎂條 D 常見鐵的合金 生鐵、氧化鐵、不銹鋼 A.A B.B C.C D.D 組卷:16引用:2難度:0.7 -
5.興趣小組進行銅綠受熱分解的實驗探究,下列操作錯誤的是( )
A. 
查氣密性B. 
裝置:加入銅綠C. 
加熱銅綠D. 
檢驗氣體組卷:18引用:3難度:0.8 -
6.下列實驗設計正確的是( )
A.實驗室用石灰石和稀硫酸制取CO2 B.用Cu與AgNO3溶液比較兩金屬活動性 C.用10mL量筒量取5.62mL水 D.用點燃的方法除去CO2中的CO 組卷:12引用:1難度:0.5 -
7.下列排序正確的是( )
A.利用金屬的年代 A1、Cu、Fe由先到后B.鐵元素的質量分數 FeO、Fe2O3、FeS由高到低C.碳元素的化合價 由高到低CH4、CO、C60D.空氣中物質的含量 由少到多CO2、N2、O2組卷:52引用:1難度:0.5 -
8.下列實驗現象的描述或實驗操作不正確的是( )
A.10.0mL酒精與10.0mL蒸餾水混合,溶液的體積會小于20.0mL B.滴瓶上的滴管使用后無需用蒸餾水清洗,直接放回原滴瓶 C.加熱含碳酸的石蕊試液,溶液由紫色變為無色 D.實驗室一氧化碳還原氧化鐵,先熄滅酒精噴燈,后停止通一氧化碳 組卷:76引用:3難度:0.6 -
9.下列指定反應的化學方程式正確的是( )
A.濕法煉銅:2Fe+3CuSO4=Fe2(SO4)3+3Cu B.鋁片溶于稀硫酸:Al+H2SO4=AlSO4+H2↑ C.工業上用赤鐵礦煉鐵:4CO+Fe3O4 3Fe+4CO2高溫D.過氧化鈉與二氧化碳常溫下反應生成碳酸鈉和氧氣:2Na2O2+2CO2=2Na2CO3+O2 組卷:23引用:2難度:0.6 -
10.以CO2和H2為原料合成異丁烷(C4H10)的微觀過程如圖。下列說法正確的是( )

A.圖示中,碳的化合物共有2種 B.轉化①為置換反應 C.原料中所有的原子全部轉化為異丁烷 D.轉化②中兩反應物分子數之比為4:9 組卷:66引用:3難度:0.5
二、解答題(共10小題,滿分0分)
-
29.現有一包固體粉末,可能含有NH4HCO3、CuSO4、C粉、CaCO3、NaCl中的一種或幾種。現做如下實驗:
(1)取少量固體微熱,沒有聞到刺激性氣味,則原固體中一定不含有。
(2)另取少量固體加足量水,產生藍色溶液和沉淀,則原固體中一定含有;向沉淀中加入足量稀鹽酸,固體全部溶解并產生氣泡,則原固體中一定還含有,一定不含。組卷:20引用:1難度:0.4 -
30.人類文明的發展和社會的進步同金屬材料關系十分密切。
(一)鐵的應用及防護
(1)生活中常用鐵鍋烹飪,主要利用鐵的(填字母)。
a.導電性
b.導熱性
c.耐腐蝕
(2)“發藍“處理是在鐵表面形成致密氧化膜,以防止其腐蝕。“發藍”的原理是:36Fe+4NaNO2+9NaNO3+26H2O=12X+13NaOH+13NH3↑,X的化學式為。
(3)患貧血癥的人體內需要補鐵(填字母)。
a.分子
b.原子
c.元素
(4)如圖為某興趣小組探究鐵生銹的三個實驗,最先觀察到鐵銹的是(選填序號)。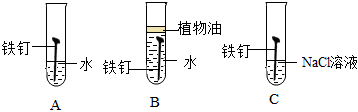
(5)鐵生銹的主要過程為:FeFe(OH)2O2、H2OFe(OH)3→Fe2O3?xH2O,寫出Fe(OH)2→Fe(OH)3反應的化學方程式O2、H2O。
(二)鐵的冶煉和探究
取20.0gFe2O3粉末,小組同學用如圖裝置模擬煉鐵,并測定反應后固體成分。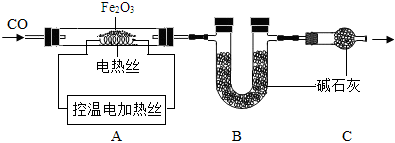
資料:堿石灰可吸收H2O和CO2。
(6)連接裝置,先,再裝入藥品。
(7)實驗時先通入CO,目的是。
(8)該實驗裝置有一個明顯缺陷,你認為是。
(9)控制A中溫度在700℃至固體全部變黑,繼續通CO至冷卻。通過測定裝置B中固體的質量變化,可準確求得裝置A中剩余固體質量。裝置C的作用是。
(10)現直接測得裝置A中剩余固體質量為17.2g。經分析該17.2g為Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反應,得H2質量為0.1g。(FexOy和稀H2SO4反應,但無氣體產生)
①固體中Fe質量為g。
②FexOy的化學式為。
(三)成分探究
【查閱資料】用CO還原Fe2O3煉鐵的過程大致分為三個階段:
階段1:3Fe2O3+C2Fe3O4+CO2500~600℃
階段2:Fe3O4+C3FeO+CO2600~700℃
階段3:FeO+COFe+CO2>700℃
另取一定量Fe2O3進行上述實驗,加熱時固體質量隨溫度變化的曲線如圖所示,回答下列問題: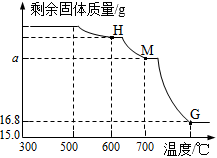
(11)溫度控制在300℃-500℃范圍時,固體質量沒有發生變化,原因是。
(12)圖中H點對應的固體成分的化學式是。
(13)圖中M點對應a的數值=。組卷:68引用:1難度:0.6


