2020年浙江省紹興市柯橋區高考化學適應性試卷(6月份)
發布:2024/4/20 14:35:0
一.選擇題(本大題共25個小題,每小題2分,共50分.每個小題列出的四個備選項中只有一個是符合題目要求的,不選、多選、錯選均不得分)
-
1.下列物質不屬于某酸酸酐的是( )
A.NO2 B.(CH3CO)2O C.SO2 D.Cl2O 組卷:58引用:1難度:0.8 -
2.某些地區的自來水含有Fe3+,實驗室可以通過蒸餾自來水的方法獲得少量純凈的水,需要用到的儀器是( )
A. 
B. 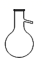
C. 
D. 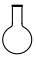 組卷:23引用:1難度:0.9
組卷:23引用:1難度:0.9 -
3.下列氣體溶于水后,既有強電解質又有弱電解質生成的是( )
A.CO2 B.SO3 C.NH3 D.Cl2 組卷:47引用:1難度:0.6 -
4.下列變化過程中,加入還原劑可以實現的是( )
A.Cu→CuO B.HCHO→CH3OH C.CO32-→CO2 D.NO→N2O4 組卷:93引用:1難度:0.8 -
5.下列我國科研成果所涉及材料中,主要成分為同主族元素形成的無機非金屬材料的是( )
A. 
4.03米大口徑碳化硅反射鏡B. 
2022年冬奧會聚氨酯速滑服C. 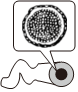
能屏蔽電磁波的碳包覆銀納米線D. 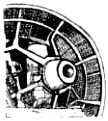
“玉兔二號”鈦合金篩網輪組卷:573引用:23難度:0.9 -
6.下列化學用語中,表示正確的是( )
A.次氯酸的結構式:H-Cl-O B.CO2的比例模型: 
C.摩爾鹽的化學式:(NH4)2SO4?FeSO4?6H2O D.氯化鎂的電子式: 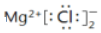 組卷:12引用:1難度:0.8
組卷:12引用:1難度:0.8 -
7.下列說法正確的是( )
A. O、188H、11H三種核素最多可以組成2種水分子21B.核內中子數為N的R2+,質量數為A,則該粒子的核外電子數為:A-N-2 C.CH3OH和CH3-O-CH3分子組成相差一個CH2,所以互為同系物 D.按系統命名法,化合物 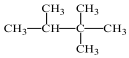 的名稱為2,3,3-三甲基丁烷組卷:30引用:1難度:0.8
的名稱為2,3,3-三甲基丁烷組卷:30引用:1難度:0.8 -
8.下列說法不正確的是( )
A.膠體區別于其他分散系的本質特征是分散質的微粒直徑在10-9~10-7m之間 B.工業上用二氧化硅在高溫下與焦炭反應可直接制得高純度的硅 C.氨氣在加壓時易液化,液氨汽化時吸收大量的熱,工業上可使用液氨作制冷劑 D.硫酸亞鐵是優良的凈水劑 組卷:47引用:1難度:0.6 -
9.下列說法不正確的是( )
A.SiO2可以與NaOH溶液反應,但不能與濃硝酸反應 B.一般可以用NaOH溶液來吸收氮的氧化物 C.CuBr2溶液分別可以與氯水、氨水、AgNO3溶液、鐵粉等發生反應 D.SO2能通過氧化還原反應使品紅溶液、紅色石蕊溶液、紫色高錳酸鉀溶液褪色 組卷:42引用:1難度:0.5 -
10.下列說法正確的是( )
A.能源可分為一次能源和二次能源,電能、頁巖氣、煤、太陽能均為一次能源 B.使用太陽能熱水器、沼氣的利用、玉米制乙醇都涉及到生物質能的利用 C.向汽油中添加甲醇后,該混合燃料的熱值發生改變 D.糖類、油脂和蛋白質都是天然有機高分子化合物 組卷:64引用:1難度:0.8
二.非選擇題(本大題共6個小題,共50分)
-
31.目前鋰電池的應用日益廣泛,而廢舊鋰電池的回收利用是十分重要的課題。回收利用廢舊鋰電池的流程如圖1所示:
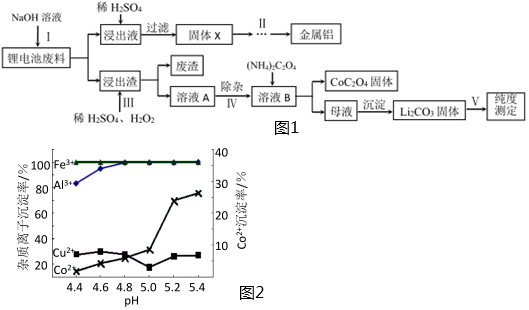
已知:①鋰電池廢料的主要成分是LiCoO2、鋁、炭黑及其他雜質。②“溶液A”中主要金屬離子是Co2+、Li+,還含有少量Fe3+、Al3+、Cu2+.請回答:
(1)步驟Ⅰ中鋁溶解的離子方程式為;步驟Ⅲ中LiCoO2固體溶解的化學方程式為。
(2)關于步驟Ⅱ,下列實驗操作或說法合理的是。
A.灼燒前,灼燒使用的蒸發皿洗凈后不需要擦干,然后加入固體X進行灼燒
B.灼燒時需要用玻璃棒不斷攪拌
C.灼燒至恒重是指前后兩次稱量所得質量之差不得超過一定的允許誤差,這個允許誤差一定為0.01g
D.在電解熔融的Al2O3制備金屬鋁時,通常需加入冰晶石(NaAlF6)以增強其導電性
(3)步驟Ⅳ中除雜時可加入氨水調節溶液的pH,實驗表明溶液A中各種金屬離子的沉淀率隨pH的變化如圖2所示,則步驟Ⅳ中可除去的雜質離子是。
(4)步驟Ⅴ可采用酸堿滴定法測定碳酸鋰的純度。滴定原理如下:碳酸鋰能夠與鹽酸反應生成氯化鋰和二氧化碳,在碳酸鋰未完全反應時,溶液保持中性(pH=7)。反應完全后,隨著鹽酸的繼續滴入,溶液pH下降,以甲基紅-溴甲粉綠為指示劑,用鹽酸標準液滴定試樣,用消耗鹽酸標準滴定溶液的量來計算碳酸鋰的含量。
①配制約0.30mol?L-1鹽酸溶液不需要用到的儀器有。(填編號)
a.量筒 b.電子天平 c.漏斗 d.燒杯 e.容量瓶 f.玻璃棒 g.膠頭滴管
②用0.3000mol?L-1鹽酸標準溶液滴定,其中正確操作步驟的順序為。
a.加入0.1~0.2mL甲基紅-溴甲粉綠作指示劑;
b.煮沸去除CO2,再冷卻到室溫;
c.將試樣置于250mL錐形瓶中,加入20mL水溶解;
d.用鹽酸標準液滴定至試液由綠色變成酒紅色;
e.繼續滴定至酒紅色(滴定突躍區域)即為終點
③碳酸鋰的純度可用下式計算:ω=×100%,其中:ω-碳酸鋰試樣的純度;m-碳酸鋰試樣的質量(g);c-鹽酸標準液的濃度(mol?L-1);V1-試樣滴定時消耗鹽酸的體積(mL);V0-滴定空白溶液(指不加試樣進行滴定)時標準鹽酸消耗的體積(mL),0.03694與1.00mL標準鹽酸(c=1.000mol?L-1)相當的碳酸鋰的質量(g)滴定空白溶液的目的是0.03694×c×(V1-V0)m。上述滴定操作中,缺少“煮沸去除CO2,再冷卻到室溫”這個步驟,測定結果將。(填“偏大”、“偏小”、“無影響”)組卷:14引用:1難度:0.4 -
32.化合物I是一種用于合成γ-分泌調節劑的藥物中間體,其合成路線流程圖如圖所示:
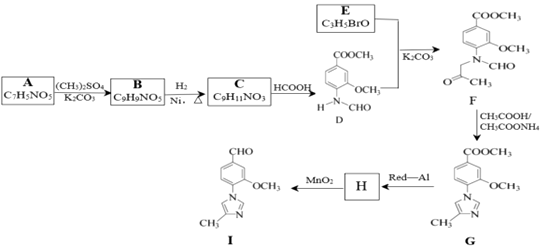
請回答:
(1)化合物E的結構簡式為。
(2)下列說法不正確的是。
A.化合物A能與FeCl3溶液發生顯色反應
B.化合物C中含氧官能團的名稱為醚鍵和酯基
C.A→B,B→C,C→D,D→F轉化過程中發生的均為取代反應
D.化合物I的分子式是C12H10N2O2
(3)寫出A→B的化學反應方程式。
(4)H的分子式為C12H14N2O2,經氧化得到I,寫出H的結構簡式。
(5)寫出同時滿足下列條件的C的所有同分異構體的結構簡式。
①含有苯環;②能發生水解反應,水解產物之一是α-氨基酸,另一水解產物分子中只有2種不同化學環境的氫。
(6)請設計以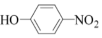 、
、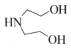 和(CH3)2SO4為原料制備
和(CH3)2SO4為原料制備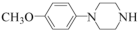 的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。 。組卷:21引用:1難度:0.5
的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。 。組卷:21引用:1難度:0.5


