2023年江蘇省南京師大附中高考化學一模試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.北京冬奧會成功舉辦、神舟十三號順利往返、“天宮課堂”精彩呈現均展示了我國科技發展的巨大成就。下列相關敘述正確的是( )
A.飛船返回艙表層材料中的玻璃纖維屬于無機非金屬材料 B.“泡騰片實驗”中,檸檬酸與小蘇打反應時,有電子的轉移 C.乙酸鈉過飽和溶液結晶形成溫熱“冰球”,該過程吸收熱量 D.吉祥物“冰墩墩”的材質中有聚氯乙烯,聚氯乙烯是純凈物 組卷:49引用:4難度:0.7 -
2.三氯化六氨合鈷[Co(NH3)6]Cl3是一種重要的化工產品,實驗室可用反應2CoCl2+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+2H2O制備。下列有關說法正確的是( )
A.基態Co2+的價層電子排布式為3d54s2 B.NH3的電子式為 
C.中子數為18的氯原子可表示為 Cl1817D.1mol[Co(NH3)6]3+中含24mol共價鍵 組卷:80引用:3難度:0.9 -
3.氮是生命的基礎,氮及其化合物在生產生活中具有廣泛應用。工業上用氨的催化氧化生產硝酸,其熱化學方程式為4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-904kJ?mol-1。生產硝酸的尾氣中主要含有NO、NO2等大氣污染物,可用石灰漿等堿性溶液吸收處理,并得到Ca(NO3)2、Ca(NO2)2等化工產品。下列氮及其化合物的性質與用途具有對應關系的是( )
A.N2不溶于水,可用作保護氣 B.NH3極易溶于水,可用作制冷劑 C.NO2具有強氧化性,可用作火箭燃料推進劑 D.HNO3具有易揮發性,可用來制備硝酸纖維 組卷:79引用:1難度:0.9 -
4.氮是生命的基礎,氮及其化合物在生產生活中具有廣泛應用。工業上用氨的催化氧化生產硝酸,其熱化學方程式為4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-904kJ?mol-1。生產硝酸的尾氣中主要含有NO、NO2等大氣污染物,可用石灰漿等堿性溶液吸收處理,并得到Ca(NO3)2、Ca(NO2)2等化工產品。實驗室采用下列裝置制取氨氣,正確的是( )

A.裝置甲生成NH3 B.裝置乙干燥NH3 C.裝置丙收集NH3并驗滿 D.裝置丁吸收多余NH3 組卷:101引用:1難度:0.7 -
5.氮是生命的基礎,氮及其化合物在生產生活中具有廣泛應用。工業上用氨的催化氧化生產硝酸,其熱化學方程式為4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-904kJ?mol-1。生產硝酸的尾氣中主要含有NO、NO2等大氣污染物,可用石灰漿等堿性溶液吸收處理,并得到Ca(NO3)2、Ca(NO2)2等化工產品。對于反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列有關說法不正確的是( )
A.該反應一定能自發進行 B.該反應的正反應的活化能小于逆反應的活化能 C.斷裂1molN-H鍵的同時斷裂1molO-H鍵,說明該反應達到平衡狀態 D.達到平衡時,增大容器的體積,v(正)增加、v(逆)減小 組卷:61引用:2難度:0.7 -
6.對于下列實驗,能正確描述其反應的離子方程式的是( )
A.向BaCl2溶液中通入SO2:Ba2++H2O+SO2═BaSO3↓+2H+ B.硫化亞鐵溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ C.同濃度同體積NH4HSO4 溶液與NaOH溶液混合:NH4++OH-═NH3?H2O D.用Na2SO3溶液吸收少量Cl2:3SO32-+Cl2+H2O═2HSO3?+2Cl?+SO42- 組卷:251引用:5難度:0.8
二、非選擇題:共4小題,共58分
-
17.實驗室研究從煉銅煙灰(主要成分為CuO、Cu2O、ZnO、PbO及其硫酸鹽)中分別回收銅、鋅、鉛元素的流程如圖。

(1)酸浸過程中,金屬元素均由氧化物轉化為硫酸鹽,其中生成CuSO4的化學方程式為:CuO+H2SO4═CuSO4+H2O、。
(2)置換過程中,鐵屑完全消耗后,銅的產率隨時間延長而下降,其可能原因為。
(3)已知,25℃時,Ksp(PbSO4)=2.5×10-8;PbSO4+2Cl?PbCl2+。一定條件下,在不同濃度的NaCl溶液中,溫度對鉛浸出率的影響、PbCl2的溶解度曲線分別如圖1、圖2所示。SO2-4
浸出后溶液循環浸取并析出PbCl2的實驗結果如下表所示。
①為提高原料NaCl溶液利用率,請補充完整利用酸浸渣制備化學純(純度≥98.5%)PbCl2晶體的實驗方案:取一定質量的酸浸渣,參數 循環次數 0 1 2 3 結晶產品中PbCl2純度/% 99.9 99.3 98.7 94.3 ,將所得晶體洗滌、干燥。(可選用的試劑:5mol?L-1NaCl溶液,1mol?L-1NaCl溶液,NaCl固體)
②循環一定次數后的溶液中加入適量CaCl2溶液,過濾并加水稀釋至其中NaCl濃度為1mol?L-1的目的是。
(4)ZnSO4?7H2O產品的純度可用配位滴定法測定。準確稱取一定量的ZnSO4?7H2O晶體加入250mL的錐形瓶中,加水約20mL。再加入2~3滴5%的二甲酚橙作指示劑、約5mL六亞甲基四胺緩沖溶液,搖勻。用已標定的0.0160mol/LEDTA溶液滴定,滴定至溶液由紅紫色變成亮黃色,即為終點(ZnSO4?7H2O與EDTA按物質的量之比1:1反應)。實驗數據如下表:
ZnSO4?7H2O產品的純度為m(ZnSO4?7H2O)/g 起始滴定管讀數/mL 終點滴定管讀數/mL 0.1692 0.20 26.50 (保留2位有效數字)。組卷:85引用:4難度:0.4 -
18.燃煤煙氣中SO2和NOx是大氣污染物的主要來源,脫硫脫硝技術是煙氣治理技術的研究熱點。
(1)尿素/H2O2溶液脫硫脫硝。尿素[CO(NH2)2]是一種強還原劑。60℃時在一定濃度的尿素/H2O2溶液中通入含有SO2和NO的煙氣,煙氣中有毒氣體被一定程度吸收。
尿素/H2O2溶液對SO2具有很高的去除效率,寫出尿素和H2O2溶液吸收SO2,生成硫酸銨和CO2的化學方程式為。
(2)除去煙氣中的NOx,利用氫氣選擇性催化還原(H2-SCR)是目前消除NO的理想方法。H2-SCR法的主反應:2NO(g)+2H2(g)═N2(g)+2H2O(g)ΔH1
副反應:2NO(g)+H2(g)═N2O(g)+H2O(g)ΔH2<0
①已知H2(g)+O2(g)═H2O(g)ΔH3=-241.5kJ/mol;N2(g)+O2(g)═2NO(g) ΔH4=+180.5kJ/mol,則ΔH1=12kJ/mol。
②H2-SCR在Pt-HY催化劑表面的反應機理如題圖1所示: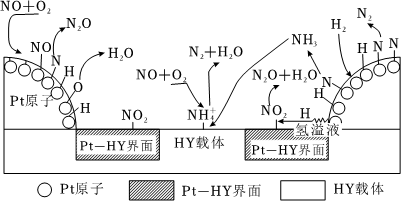
已知在HY載體表面發生反應的NO、O2物質的量之比為4:1,反應中每生成1molN2,轉移的電子的物質的量為mol。
(3)V2O5/羰基材料(活性炭、活性焦、活炭纖維)也可以脫硫脫硝。V2O5/羰基材料脫硫原理是:SO2在炭表面被吸附,吸附態SO2在炭表面被催化氧化為SO3,SO3再轉化為硫酸鹽等。
①V2O5/羰基材料脫硫時,通過紅外光譜發現,脫硫開始后催化劑表面出現了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,該脫硫反應過程可描述為。
②V2O5/羰基材料脫硫時,控制一定氣體流速和溫度,考查了煙氣中O2的存在對V2O5/羰基材料催化劑脫硫脫硝活性的影響,結果如題圖2所示,當O2濃度過高時,去除率下降,其可能原因是。 組卷:137引用:2難度:0.6
組卷:137引用:2難度:0.6


