2022年江蘇省鹽城市阜寧中學高考化學質檢試卷(三)
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.《厲害了,我的國》“中國名片”中航天、軍事、天文等領域的發展受到世界矚目。它們與化學有著密切聯系。下列說法正確的是( )
A.“中國天眼”的“眼眶”是鋼鐵結成的圈梁,屬于新型無機非金屬材料 B.“復興號”車廂連接處關鍵部位使用的增強聚四氟乙烯板屬于無機非金屬材料 C.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結構陶瓷是新型無機非金屬材料 D.“天宮二號”空間實驗室的太陽能電池板的主要材料是二氧化硅 組卷:37引用:7難度:0.7 -
2.在陽光照射下,水和氧氣在浸泡過KOH溶液的三噻吩(C12H8S3)聚合物表面能高效合成過氧化氫(H2O2),下列說法不正確的是( )
A.H2O2的電子式為:H+ 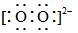 H+
H+B.H2O為極性分子 C.KOH為離子晶體 D.S2-的結構示意圖為 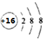 組卷:28引用:4難度:0.7
組卷:28引用:4難度:0.7 -
3.給定條件下,下列選項中所示的物質間轉化均能一步實現的是( )
A.粗硅 SiCl4Cl2高溫SiH2高溫B.Mg(OH)2 MgCl2(aq)鹽酸Mg電解C.Fe2O3 FeCl3(aq)鹽酸無水FeCl3蒸發D.AgNO3(aq) [Ag(NH3)2]OH(aq)NH3?H2OAg蔗糖△組卷:587引用:25難度:0.9 -
4.下列有關NO2、NO3-、NO2-的說法不正確的是( )
A.NO3-與NO2-中心原子雜化類型相同,均采用sp2雜化 B.NO3-的空間構型為平面三角形 C.NO2與堿性溶液反應可以生成NO3-和NO2- D.Ca(NO3)2、Ca(NO2)2都具有還原性 組卷:38引用:1難度:0.7 -
5.下列有關合成氨反應的說法正確的是( )
A.反應的ΔS>0 B.反應的ΔH=E(N-N)+3E(H-H)-6E(N-H) (E表示鍵能) C.反應中每消耗1molH2轉移電子的數目約等于2×6.02×1023 D.反應在高溫、高壓和催化劑條件下進行可提高H2的平衡轉化率 組卷:26引用:1難度:0.7 -
 6.如圖-1所示,室溫下用排飽和食鹽水法在集氣瓶中先后收集體積的Cl2和45體積的CH4氣體,用強光照射瓶中的混合氣體。下列說法正確的是( )15
6.如圖-1所示,室溫下用排飽和食鹽水法在集氣瓶中先后收集體積的Cl2和45體積的CH4氣體,用強光照射瓶中的混合氣體。下列說法正確的是( )15A.可用水代替飽和食鹽水收集Cl2 B.生成的氯代烴都不存在同分異構體 C.反應結束后集氣瓶中充滿液體 D.如圖-2所示的NaCl晶胞中含14個Na+ 組卷:28引用:2難度:0.7
二、解答題(共4小題,滿分58分)
-
17.以軟錳礦粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)為原料制備電池級MnO2。
(1)浸取。將一定量軟錳礦粉與Na2SO3、H2SO4溶液中的一種配成懸濁液,加入到三頸瓶中(裝置見圖1),70℃下通過滴液漏斗緩慢滴加另一種溶液,充分反應,過濾。滴液漏斗中的溶液是;MnO2轉化為Mn2+的離子方程式為。
(2)除雜。向已經除去Fe、Al、Si的MnSO4溶液(pH約為5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上層清液中c(F-)=0.05mol?L-1,則=c(Ca2+)c(Mg2+)。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制備MnCO3。在攪拌下向100mL1mol?L-1MnSO4溶液中緩慢滴加1mol?L-1NH4HCO3溶液,過濾、洗滌、干燥,得到MnCO3固體。需加入NH4HCO3溶液的體積約為。
(4)制備MnO2。MnCO3經熱解、酸浸等步驟可制備MnO2。MnCO3在空氣氣流中熱解得到三種價態錳的氧化物,錳元素所占比例(×100%)隨熱解溫度變化的曲線如圖2所示。已知:MnO與酸反應生成Mn2+;Mn2O3氧化性強于Cl2,加熱條件下Mn2O3在酸性溶液中轉化為MnO2和Mn2+。為獲得較高產率的MnO2,請補充實驗方案:取一定量MnCO3置于熱解裝置中,通空氣氣流,某價態錳的氧化物中錳元素質量錳元素總質量,固體干燥,得到MnO2。(可選用的試劑:1mol?L-1H2SO4溶液、2mol?L-1HCl溶液、BaCl2溶液、AgNO3溶液)。組卷:386引用:5難度:0.6 -
18.地下水中硝酸鹽造成的氮污染已成為一個世界性的環境問題。水體除NO3-主要有電化學法、催化還原法等。
(1)電化學去除弱酸性水體中NO3-的反應原理如圖1所示: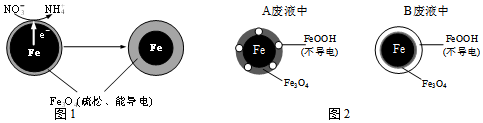
①作負極的物質是。
②正極的電極反應式是。
③取兩份完全相同的含NO3-廢液A和B,調節廢液A、B的pH分別為2.5和4.5,向廢液A、B中加入足量鐵粉,經相同時間充分反應后,廢液A、B均接近中性。廢液A、B中鐵的最終物質存在形態分別如題18圖-2所示。溶液的初始pH對鐵的氧化產物有影響,具體影響為。廢液中NO3-的去除率較低的是(“廢液A”和“廢液B”),NO3-的去除率低的原因是。
(2)納米Fe-Ni去除廢液中的NO3-(Ni不參與反應)。
①在酸性條件下,Fe與NO3-反應生成Fe2+和NH4+,則反應的離子方程式為。
②初始pH=2.0的廢液,加入一定量的納米Fe-Ni,反應一段時間后,廢液中出現大量白色絮狀沉淀物,過濾后白色沉淀物在空氣中逐漸變成紅褐色。產生上述現象的原因是。
(3)在金屬Pt、Cu和Ir(銥)的催化作用下,H2可高效轉化酸性溶液中的NO3-,其工作原理如圖3所示。H2在金屬Pt和Cu的催化作用下將NO3-轉化為液體中N2O的過程可描述為。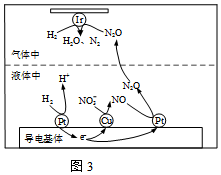 組卷:54引用:2難度:0.5
組卷:54引用:2難度:0.5


