2022-2023學年福建省廈門市集美中學高三(上)月考化學試卷(10月份)
發(fā)布:2024/9/20 16:0:8
一、選擇遈(每題只有一個選項符合題意,每題3分,共45分)
-
1.化學物質(zhì)在體育領(lǐng)域有廣泛用途。下列說法錯誤的是( )
A.滌綸可作為制作運動服的材料 B.纖維素可以為運動員提供能量 C.木糖醇可用作運動飲料的甜味劑 D.“復(fù)方氯乙烷氣霧劑”可用于運動中急性損傷的鎮(zhèn)痛 組卷:320引用:7難度:0.8 -
2.生活因化學更美好。以下生活用途和化學原理都正確且具有對應(yīng)關(guān)系的是( )
選項 生活用途 化學原理 A 維生素C幫助人體將Fe3+轉(zhuǎn)化為易吸收的Fe2+ 維生素C具有還原性 B 葡萄酒中添加二氧化硫 二氧化硫具有漂白性 C 過氧化鈉用作呼吸面具中的供氧劑 過氧化鈉分解放出氧氣 D 明礬可用作凈水劑和消毒劑 鋁離子水解生成氫氧化鋁膠體 A.A B.B C.C D.D 組卷:45引用:3難度:0.7 -
3.《醫(yī)學入門》中記載我國傳統(tǒng)中醫(yī)提純銅綠的方法:“水洗凈,細研水飛,去石澄清,慢火熬干。”其中未涉及的操作是( )
A.洗滌 B.粉碎 C.萃取 D.蒸發(fā) 組卷:233引用:20難度:0.5 -
4.依據(jù)下列實驗,預(yù)測的實驗現(xiàn)象正確的是( )
選項 實驗內(nèi)容 預(yù)測的實驗現(xiàn)象 A MgCl2溶液中滴加NaOH溶液至過量 產(chǎn)生白色沉淀后沉淀消失 B FeCl2溶液中滴加KSCN溶液 溶液變血紅色 C AgI懸濁液中滴加NaCl溶液至過量 黃色沉淀全部轉(zhuǎn)化為白色沉淀 D 酸性KMnO4溶液中滴加乙醇至過量 溶液紫紅色褪去 A.A B.B C.C D.D 組卷:323引用:7難度:0.6 -
5.
O、138O的半衰期很短,自然界中不能穩(wěn)定存在。人工合成反應(yīng)如下:158O+168He→32O+138X;abO+168He→32O+158Y。下列說法正確的是( )mnA.X的中子數(shù)為2 B.X、Y互為同位素 C. O、138O可用作示蹤原子研究化學反應(yīng)歷程158D.自然界不存在 O2、138O2分子是因其化學鍵不穩(wěn)定158組卷:417引用:6難度:0.6 -
6.鍍鋅鐵釘放入棕色的碘水中,溶液褪色;取出鐵釘后加入少量漂白粉,溶液恢復(fù)棕色;加入CCl4,振蕩,靜置,液體分層。下列說法正確的是( )
A.褪色原因為I2被Fe還原 B.液體分層后,上層呈紫紅色 C.鍍鋅鐵釘比鍍錫鐵釘更易生銹 D.溶液恢復(fù)棕色的原因為I-被氧化 組卷:286引用:5難度:0.7
二、填空題(4題,共55分)
-
18.以黃鐵礦(主要成分FeS2)為原料生產(chǎn)硫酸,應(yīng)將產(chǎn)出的爐渣和尾氣進行資源化綜合利用,減輕對環(huán)境的污染。其中一種流程如圖所示。
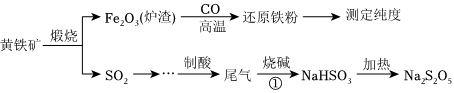
回答下列問題:
(1)黃鐵礦中硫元素的化合價為。
(2)由爐渣制備還原鐵粉的化學方程式為。
(3)欲得到更純的NaHSO3,反應(yīng)①應(yīng)通入(填“過量”或“不足量”)的SO2氣體。
(4)因為Na2S2O5具有性,導(dǎo)致商品Na2S2O5 中不可避免地存在Na2SO4。檢驗其中含有的方法是SO2-4。
(5)一般用 K2Cr2O7滴定分析法測定還原鐵粉純度。實驗步驟:稱取一定量樣品,用過量稀硫酸溶解,用標準K2Cr2O7溶液滴定其中的Fe2+。
反應(yīng)式:Cr2+6Fe2++14H+═2Cr3++6Fe3++7H2OO2-7
某次實驗稱取0.2800g樣品,滴定時消耗濃度為0.03000mol?L-1的K2Cr2O7溶液25.10mL,則樣品中鐵含量為%。組卷:356引用:7難度:0.5 -
19.用如下方法回收廢舊CPU中的單質(zhì)Au(金),Ag和Cu。

已知:
①濃硝酸不能單獨將Au溶解。
②HAuCl4?H++AuCl-4
(1)酸溶后經(jīng)操作,將混合物分離。
(2)濃、稀HNO3均可作酸溶試劑。溶解等量的Cu消耗HNO3的物質(zhì)的量不同,寫出消耗HNO3物質(zhì)的量少的反應(yīng)的化學方程式:
(3)HNO3-NaCl與王水[V(濃硝酸):V(濃鹽酸)=1:3]溶金原理相同。
①將溶金反應(yīng)的化學方程式補充完整:Au+NaCl+HNO3═HAuCl4+++NaNO3
②關(guān)于溶金的下列說法正確的是。
A.用到了HNO3的氧化性
B.王水中濃鹽酸的主要作用是增強溶液的酸性
C.用濃鹽酸與NaNO3也可使Au溶解
(4)若用Zn粉將溶液中的1mol HAuCl4完全還原,則參加反應(yīng)的Zn的物質(zhì)的量是mol。
(5)用適當濃度的鹽酸、NaCl溶液、氨水與鐵粉,可按照如下方法從酸溶后的溶液中回收Cu和Ag(圖中標注的試劑和物質(zhì)均不同)。試劑1是;試劑2是。 組卷:541引用:9難度:0.4
組卷:541引用:9難度:0.4


