2017-2018學年福建師大二附中高二(上)期末化學試卷
發布:2024/12/24 12:0:4
一、選擇題(本題包括25小題,每題2.5分,共50分。每小題只有一個選項符合題意。)
-
1.下列描述中,不符合生產實際的是( )
A.電解法精煉銅,用粗銅作陽極 B.電解熔融的氯化鋁取金屬鋁,用鐵作陽極 C.電解飽和食鹽水制燒堿,用涂鎳碳鋼碳網作陰極 D.在鍍件上電鍍鋅,用鋅作陽極 組卷:1引用:3難度:0.7 -
2.25℃下,0.1mol/L的Na2S溶液,下列敘述正確的是( )
A.升高溫度,溶液的pH降低 B.加入NaOH固體,溶液中的c(Na+)、c(S2-)均增大 C.c(Na+)>c(OH-)>c(S2-)>c(H+) D.2c(Na+)=c(S2-)+c(HS-)+c(H2S) 組卷:30引用:2難度:0.9 -
3.下列過程或現象與鹽類水解無關的是( )
A.純堿溶液去油污 B.加熱稀醋酸溶液其pH稍有減小 C.小蘇打溶液與AlCl3溶液混合產生氣體和沉淀 D.濃的硫化鈉溶液有臭味 組卷:58引用:20難度:0.7 -
4.下列描述中正確的是( )
A.HCl和NaOH反應的中和熱ΔH=-57.3kJ?mol-1,則H2SO4和Ba(OH)2反應的中和熱ΔH=2×(-57.3)kJ?mol-1 B.CO(g)的燃燒熱是283.0kJ?mol-1,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+2×283.0kJ?mol-1 C.犧牲陽極的陰極保護法是應用電解原理防止金屬的腐蝕 D.測氯水的pH時,可用干燥潔凈的玻璃棒蘸取氯水點在pH試紙上,待其變色后和標準比色卡比較 組卷:2引用:1難度:0.8 -
5.一定溫度下,固定體積的容器中充入1mol SO2和1mol O2,再加入少量的NO,在體系中發生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列說法中不正確的是( )
A.體系中的總反應是:2SO2+O2?2SO3 B.在反應過程中NO是催化劑 C.NO參與反應歷程,降低反應活化能,加快反應速率 D.NO的引入可以增加SO2的平衡轉化率 組卷:51引用:7難度:0.7 -
6.如圖小試管內為紅墨水,具支試管內盛有pH=4久置的雨水和生鐵片.實驗觀察到:開始時導管內液面下降,一段時間后導管內液面回升,略高于小試管內液面.下列說法正確的是( )
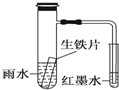
A.生鐵片中的碳是原電池的負極,發生還原反應 B.雨水酸性較強,生鐵片始終發生析氫腐蝕 C.具支試管中溶液酸性增強 D.墨水回升時,碳電極反應式為O2+2H2O+4e-═4OH- 組卷:33引用:3難度:0.7 -
7.鎳鎘(Ni-Cd)可充電電池在現代生活中有廣泛應用.已知某鎳鎘電池的電解質溶液為KOH溶液,其充、放電按下式進行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2.有關該電池的說法正確的是( )放電充電A.充電時陽極反應:Ni(OH)2-e-+OH-═NiOOH+H2O B.充電過程是化學能轉化為電能的過程 C.放電時負極附近溶液的堿性不變 D.放電時電解質溶液中的OH-向正極移動 組卷:867引用:115難度:0.7 -
8.下列各表述與示意圖一致的是( )
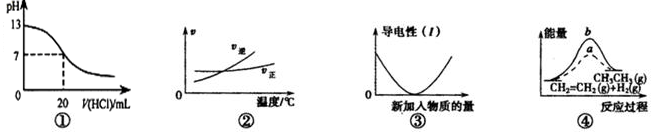
A.圖①表示25℃時,用0.1mol?L-1鹽酸滴定20mL 0.1mol?L-1NaOH溶液,溶液的pH隨加入酸體積的變化 B.根據圖②可判斷可逆反應A2(g)+3B2(g)?2AB3(g)的ΔH<0 C.圖③可表示向Ba(OH)2溶液中加入Na2SO4溶液至過量時溶液導電性的變化 D.圖④中a、b曲線分別表示反應CH2=CH2(g)+H2(g)→CH3CH3(g)ΔH>0未使用和使用催化劑時,反應過程中的能量變化 組卷:32引用:3難度:0.6 -
9.在容積不變的密閉容器中存在如下反應:2SO2(g)+O2(g)
2SO3(g)△H<0.某研究小組研究了其他條件不變時,改變某一條件對上述反應的影響,下列分析不正確的是( )V2O5450℃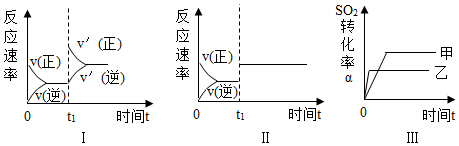
A.圖Ⅰ表示的是t1時刻增大壓強對反應速率的影響 B.圖Ⅱ表示的是t1時刻加入催化劑對反應速率的影響 C.圖Ⅲ表示的是溫度對平衡的影響,且T甲小于T乙 D.圖Ⅲ表示的是催化劑對化學平衡的影響,乙使用了催化劑 組卷:192引用:3難度:0.5 -
10.工業上制備純硅反應是SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ?mol-1(Q>0).某溫度、壓強下,將一定量反應物通入密閉容器進行以上反應,下列敘述正確的是( )
A.反應過程中,若降低壓強能提高SiCl4的轉化率 B.若反應開始時SiCl4為1 mol,則平衡時,吸收熱量為QkJ C.將反應的溫度由T1升高至T2,則反應的平衡常數K1>K2 D.當反應吸收熱量為0.25QkJ時,生成的HCl恰好能與1 molNaOH反應 組卷:8引用:2難度:0.7 -
11.某化學研究性學習小組在學習了《化學反應原理》后作出了如下的歸納總結,其中正確的是( )
A.pH=1和pH=2的鹽酸,c(H+)之比為1:2 B.物質A三態間的轉化如下:A(g)→A(l)→A(s),則該轉化過程中△S<0 C.pH=13的強堿溶液,加水稀釋后,溶液中所有離子的濃度均變小 D.pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,兩溶液中水的電離程度相同 組卷:90引用:5難度:0.5
二、填空題
-
34.有A、B、C、D四種強電解質,它們在水中電離產生下列離子(每種物質只含一種陰離子且互不重復).
已知:①A、C溶液的pH均大于7,A、B的溶液中水的電離程度相同;②C溶液和D溶液相遇時只生成白色沉淀,B溶液和C溶液相遇時只生成刺激性氣味的氣體,A溶液和D溶液混合時無現象.陽離子 Na+、Ba2+、NH4+ 陰離子 CH3COO-、OH-、Cl-、SO42-
(1)A是,B是(填化學式).
(2)用離子方程式表示A溶液pH大于7的原因:.
(3)寫出C和D反應的離子方程式.
(4)25℃時,0.1mol?L-1 B溶液的pH=a,則B溶液中c(H+)-c(NH3?H2O)=(用含有a的關系式表示).
(5)將等體積、等物質的量濃度的B溶液和C溶液混合,反應后溶液中各種離子濃度由大到小的順序是.組卷:31引用:3難度:0.3 -
35.Ⅰ.在0.1mol?L-1的重鉻酸鉀(K2Cr2O7)溶液中存在如下平衡:Cr2O72-+H2O?2HCrO4-?2CrO42-+2H+
(1)重鉻酸鉀溶液呈性,在強堿溶液中,鉻元素的主要存在形式為(填離子符號),向重鉻酸鉀溶液中加入適量稀硫酸,溶液中將c(Cr2O2-7)c(CrO2-4)。(填“增大”、“減小”或“不變”)
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測該溶液中各離子濃大小順序可能有如下四種關系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填寫下列空白:
(2)若溶液中只溶解了一種溶質,則該溶質是,上述四種離子濃度的大小順序為。(選填序號)
(3)若上述關系中③是正確的,則溶液中的溶質為;若上述關系中④是正確的,則溶液中的溶質為。
(4)若該溶液是由等體積的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)(填“大于”、“小于”或“等于”)c(NH3?H2O)。組卷:9引用:1難度:0.6


