2023-2024學年河北省石家莊市部分高中高三(上)期中化學試卷
發布:2024/10/12 6:0:3
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生活、生產、科技等密切相關。下列說法不正確的是( )
A.“酒中之水,皆可蒸燒”是因為酒精的沸點比水的沸點低 B.SiO2用作光導纖維,是因為其具有強導電性 C.維生素C用作食品中的防腐劑,是因為維生素C有較強的還原性 D.古壁畫紅色顏料用鐵紅,是由于其在空氣中性質穩定 組卷:9引用:3難度:0.5 -
2.下列類比或推理合理的是( )
選項 已知 方法 結論 A 碘遇淀粉顯藍色 類比 溴單質遇淀粉變藍色 B Na2SO3在空氣中易變質 類比 Na2CO3在空氣中也易變質 C HCl是強酸 推理 HF是強酸 D NH3有還原性 推理 PH3有強還原性 A.A B.B C.C D.D 組卷:6引用:4難度:0.5 -
3.下列實驗操作規范且能達到實驗目的的是( )




A.用排水法收集NO B.分離Fe(OH)3膠體 C.驗證酸性:H2CO3>Al(OH)3 D.加熱FeCl2?6H2O制取無水FeCl2 A.A B.B C.C D.D 組卷:12引用:4難度:0.7 -
4.下列各組物質中,只用蒸餾水(可用組內物質)無法檢驗的是( )
A.無水硫酸銅、硫酸鈉、硫酸鋇 B.過氧化鈉、碳酸鈉、碳酸氫鈉 C.碳酸鈉、氫氧化鈉、硫酸鉀 D.濃硫酸、NaOH溶液、苯 組卷:7引用:4難度:0.5 -
 5.科學研究發現金屬生銹時,銹層內如果有硫酸鹽會加快金屬的腐蝕,其腐蝕原理如圖所示。下列說法錯誤的是( )
5.科學研究發現金屬生銹時,銹層內如果有硫酸鹽會加快金屬的腐蝕,其腐蝕原理如圖所示。下列說法錯誤的是( )A.鋼鐵的腐蝕中正極電極反應式為O2+4e-+2H2O=4OH- B.酸雨地區的鋼鐵更易被腐蝕 C.Fe(OH)2生成FeO(OH)反應的化學方程式為2Fe(OH)2+O2=2FeO(OH)+H2O D.硫酸鹽加速電子傳遞,有一定的催化劑作用 組卷:48引用:6難度:0.5 -
6.下列離子方程式書寫正確的是( )
A.向NaAlO2溶液中通入過量CO2:2 +CO2+3H2O=2Al(OH)3↓+AlO-2CO2-3B.CuO溶于NaHSO4溶液:CuO+2 =Cu2++HSO-4+H2OSO2-4C.向NaNO3溶液中通入SO2:2 +SO2=2NO2+NO-3SO2-4D.Fe與稀硝酸反應,當n(Fe):n(HNO3)=1:3時:4Fe+3 +12H+=3Fe2++Fe3++3NO↑+6H2ONO-3組卷:18引用:3難度:0.8
二、非選擇題:本題共4小題,共58分。
-
17.鉍(Bi)的化合物廣泛應用于電子、醫藥等領域。由輝鉍礦(主要成分為Bi2S3,含FeS、CuO、SiO2等雜質)制備NaBiO3的工藝流程如圖:

已知:
ⅰ.NaBiO3難溶于冷水;
ⅱ.“氧化浸取”時,鉍元素轉化為Bi3+,硫元素轉化為硫單質;
ⅲ.Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
回答下列問題。
(1)“氧化浸取”步驟中溫度升高可以增大速率,但高于50℃時浸取速率會下降,其可能的原因是。濾渣1經過除硫后的另一種成分在工業上用途廣泛,寫出一種用途:。
(2)“氧化浸取”時,FeS發生反應的離子方程式為。
(3)“除鐵”步驟中調節pH最好選用的試劑為(填字母)。
A.稀硫酸
B.碳酸鈉
C.三氧化二鉍
D.氨水
(4)“轉化”時,生成NaBiO3的反應中氧化劑與氧化產物的物質的量之比為。
(5)NaBiO3產品純度的測定。取NaBiO3產品wg,加入足量稀硫酸和amol?L-1FeSO4稀溶液10mL使其完全反應(Bi被還原為+3價),再用bmol?L-1K2Cr2O7標準溶液滴定溶液中剩余的Fe2+(Cr被還原為+3價),恰好消耗10mLK2Cr2O7標準溶液。該產品的純度為(用含w、a、b的代數式表示)。
(6)組裝為如圖裝置后發現導線中電流方向為石墨1→石墨2,則該裝置的負極為,石墨2電極上的電極反應式為。 組卷:15引用:3難度:0.5
組卷:15引用:3難度:0.5 -
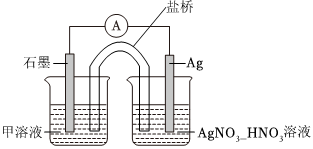 18.某小組在驗證反應“Fe+2Ag+=Fe2++2Ag”,實驗探究過程如下。結合探究過程回答下列問題。
18.某小組在驗證反應“Fe+2Ag+=Fe2++2Ag”,實驗探究過程如下。結合探究過程回答下列問題。
向硝酸酸化的0.05mol?L-1硝酸銀溶液中(忽略Ag+的水解)加入過量鐵粉,攪拌后靜置,一段時間后,將燒杯底部黑色固體過濾,濾液呈黃色。
(1)檢測到濾液中含有Fe3+,可以選用的試劑為(填化學式)溶液。Fe3+產生的原因可能有以下幾種。
假設a:可能是鐵粉表面有氧化層,能產生Fe3+。
假設b:空氣中存在O2,Fe2+被氧化為Fe3+,寫出反應的離子方程式:。
假設c:酸性溶液中的具有氧化性,可產生Fe3+。NO-3
(2)某同學證明上面假設c不成立,向硝酸酸化的硝酸鈉溶液中加入過量鐵粉,攪拌后靜置,一段時間后,上層清液未變黃色,經檢驗無Fe3+。
(3)取過濾后的黑色固體,洗滌后,(填操作和現象),證明黑色固體中含有Ag。
(4)某同學利用原電池證明Ag+可以將Fe2+氧化為Fe3+,設計了如圖所示的原電池裝置。連接裝置后,電流表中有電流通過,一段時間后電流表不再偏轉(所用溶液均已去除O2)。甲溶液中的溶質為。寫出石墨電極上發生的電極反應式:。電流表指針不再偏轉后,向左側燒杯中加入FeCl3固體,發現電流表指針反向偏轉,此時石墨電極為(填“正極”或“負極”),銀電極的電極反應式為。組卷:95引用:4難度:0.5


