2016-2017學年山東省棗莊市滕州五中高三(下)第三周周測化學試卷
發布:2025/1/3 7:0:2
一、選擇題
-
1.在生產生活中,下列不屬于化學變化的是( )
A.用鐵礦石冶煉鐵 B.用鋁熱反應焊接鐵軌 C.用石油分餾得汽油 D.氯堿工業制氫氧化鈉 組卷:13引用:2難度:0.7 -
2.下列化學用語表示正確的是( )
A.乙烯的結構簡式:CH2CH2 B.硫酸的電離方程式:H2SO4═2H++SO42- C.S2-的結構示意圖: 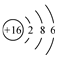
D.CCl4的電子式: 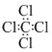 組卷:19引用:4難度:0.8
組卷:19引用:4難度:0.8 -
3.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.通常狀況下,NA個N2所占的體積約為22.4L B.1L 1mol?L-1NaOH水溶液中含有的氧原子數為NA C.足量Na與1molCl2完全反應,轉移電子的數目為2NA D.1mol Na2O2中含有的陰離子數為2NA 組卷:4引用:2難度:0.7 -
4.繼科學家發現C3O2是金星大氣成分之后,美國科學家通過“勇氣”號太空車探測出水星大氣中含有一種稱為硫化羰(化學式為COS)的物質,已知硫化羰與二氧化碳的結構相似,但在氧氣中會燃燒,下列有關C3O2與硫化羰的說法中不正確的是( )
A.硫化羰在氧氣中完全燃燒后的生成物是CO2和SO2 B.C3O2與CO一樣可以在氧氣中燃燒生成CO2 C.COS分子中所有原子都滿足8電子穩定結構 D.CO、C3O2、CO2都是碳的氧化物,它們互為同素異形體 組卷:51引用:4難度:0.9 -
5.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、 、Na+、NO-3SO2-4B.c(H+)/c(OH-)=1012的水溶液中: 、Al3+、Cl-、NH+4NO-3C.水電離出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、 HCO-3D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、 、SCN-SO2-4組卷:8引用:4難度:0.7 -
6.用H2O2溶液處理含NaCN的廢水的反應原理為:NaCN+H2O2+H2O═NaHCO3+NH3,已知:HCN酸性比H2CO3弱.下列有關說法正確的是( )
A.該反應中氮元素被氧化 B.該反應中H2O2作還原劑 C.實驗室配制NaCN溶液時,需加入適量的NaOH溶液 D.0.1mol?L-1NaCN溶液中含HCN和CN-總數目為0.1×6.02×1023 組卷:205引用:13難度:0.9
三、實驗題
-
17.草酸鈷用途廣泛,可用于指示劑和催化劑制備.一種利用水鈷礦[主要成分為Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4?2H2O工藝流程如圖1:
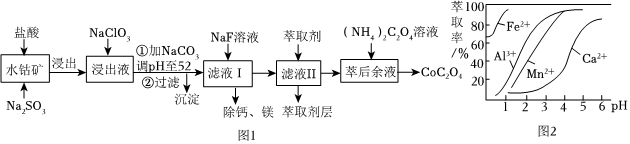
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
(1)浸出過程中加入Na2SO3的目的是將沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2 完全沉淀的pH 3.7 9.6 9.2 5.2 9.8 還原(填離子符號)以便固體溶解.該步反應的離子方程式為(寫一個).
(2)NaClO3的作用是將浸出液中的Fe2+氧化成Fe3+,氯元素被還原為最低價.該反應的離子方程式為.
(3)利用平衡移動原理分析:加Na2CO3能使浸出液中Fe3+、Al3+轉化成氫氧化物沉淀的原因是.
(4)萃取劑對金屬離子的萃取率與pH的關系如圖2所示.濾液Ⅱ中加入萃取劑的作用是;使用萃取劑適宜的pH=(填序號)左右:
A.2.0 B.3.0 C.4.0
(5)濾液Ⅰ“除鈣、鎂”是將溶液中Ca2+與Mg2+轉化為MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.當加入過量NaF后,所得濾液c(Mg2+)/c (Ca2+)=.組卷:101引用:9難度:0.3
四、推斷題
-
18.有機物A有如圖所示的轉化關系

已知①有機物B是芳香烴的含氧衍生物,其相對分子質量為108,B中氧的質量分數為14.8%
②CH3CH2COOH+Cl2PCl3△ +HCl
+HCl
③G分子結構中含有3個六元環
根據以上信息,回答下列問題:
(1)有機物F中官能團的名稱是。
(2)A的名稱是。
(3)條件Ⅲ為,F→G的反應類型為,G的結構簡式為。
(4)寫出一種檢驗M中官能團的化學方程式。
(5)R是N的同系物,相對分子質量比N大14,R有多種同分異構體,則同時符合下列條件的同分異構體有種,其中核磁共振氫譜為4組峰,且峰面積之比為3:2:2:1的有機物結構簡式為。
a.含有苯環 b.能發生銀鏡反應 c.遇FeCl3溶液不顯紫色 d.不含醚鍵
(6)寫出下列轉化的化學方程式:F→E。組卷:105引用:2難度:0.1


