2020-2021學年湖南省郴州市高二(上)期末化學試卷(選擇考)
發布:2024/4/20 14:35:0
一、選擇題(共15小題,每小題3分,滿分45分)
-
1.古代造紙工藝中使用的某種物質存在副作用,它易導致紙張發生酸性腐蝕,使紙張變脆,易破損,該物質是( )
A.生石灰 B.草木灰 C.明礬 D.漂白粉 組卷:63引用:4難度:0.9 -
2.下列物質不屬于電解質的是( )
A.BaSO4 B.NaOH C.HCl D.CO2 組卷:8引用:1難度:0.8 -
3.下列變化過程中,需要吸熱的是( )
A.鎂與鹽酸反應 B.碘單質升華 C.濃硫酸溶于水 D.天然氣燃燒 組卷:23引用:1難度:0.7 -
4.對于反應2SO2(g)+O2(g)?2SO3(g)△H<0,下列措施中,既能使正反應速率增大,又能使平衡正向移動的是( )
A.移去部分SO3 B.增大容積的體積 C.恒容通入大量的O2 D.升高體系的溫度 組卷:13引用:1難度:0.7 -
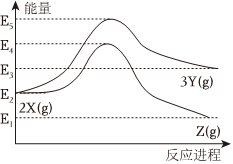 5.由反應物X轉化為Y或Z的能量變化如圖所示,下列說法正確的是( )
5.由反應物X轉化為Y或Z的能量變化如圖所示,下列說法正確的是( )A.反應2X(g)?Z(g)的ΔH=E2-E1 B.加入催化劑可降低反應的活化能 C.若增大壓強,不僅可以加快反應速率,還可以提高Y的產率 D.僅從能量角度考慮,物質的穩定性:Y>X>Z 組卷:25引用:2難度:0.7 -
6.已知合成氨的反應:N2(g)+3H2(g)?2NH3(g),在一定條件下達到平衡。下列說法正確的是( )
A.反應停止了 B.H2的轉化率為100% C.N2的濃度為0 D.v正(N2)=v逆(N2) 組卷:20引用:1難度:0.7
二、填空題(共5小題,每小題10分,滿分55分)
-
19.研究電解質在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的電離常數如表:
①寫出H2S的Ka1的表達式:化學式 HF H2CO3 H2S 電離平衡常數K(25℃) 7.2×10-4 Ka1═4.4×10-7
Ka2═4.7×10-11Ka1═9.1×10-8
Ka2═1.1×10-12;
②常溫下,pH相同的三種溶液NaF、Na2CO3、Na2S,物質的量濃度最小的是。
③將過量H2S通入Na2CO3溶液,反應的離子方程式是。
(2)室溫下,用0.100mol?L-1鹽酸溶液滴定20.00mL 0.100mol?L-1的氨水溶液,滴定曲線如圖1所示。(忽略溶液體積的變化,①②b填“>”“<”或“=”)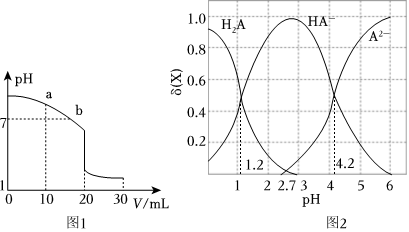
①a點所示的溶液中c(NH3?H2O)c(Cl-)。
②b點所示的溶液中c(Cl-)c()。NH+4
③室溫下pH=11的氨水與pH=5的NH4Cl溶液中,由水電離出的c(H+)之比為。
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物質的量分數δ(X)隨pH的變化如圖2所示。則H2A第二級電離平衡常數Ka2=。組卷:35引用:4難度:0.6 -
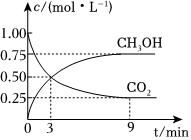 20.我國政府莊嚴承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%.CO2可轉化成有機物實現碳循環,有效降低碳排放.
20.我國政府莊嚴承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%.CO2可轉化成有機物實現碳循環,有效降低碳排放.
(1)在體積為2L的恒容密閉容器中,充入2mol CO2和6mol H2,一定條件下反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=-49.0kJ?mol-1,測得CO2和CH3OH(g)濃度隨時間變化如圖所示.
①計算:從0min到3min,H2的平均反應速率v(H2)=mol?L-1?min-1.
②能說明上述反應達到平衡狀態的是。(填序號)
A.c(CO2):c(H2)=1:3
B.混合氣體的密度不再發生變化
C.單位時間內消耗3mol H2,同時生成1mol H2O
D.CO2的體積分數在混合氣體中保持不變
③反應達到平衡后,保持其他條件不變,能加快反應速率且使體系中氣體的物質的量減少,可采取的措施有。(填編號)
A.升高溫度
B.縮小容器體積
C.再充入CO2氣體
D.使用合適的催化劑
(2)煤燃燒產生的煙氣中含有氮的氧化物,用甲烷催化氧化可以還原NOx原理為:
①CH4(g)+2NO2(g)?CO2(g)+N2(g)+H2O(g)ΔH=-867.0kJ/mol;
②N2(g)+2O2(g)?2NO2(g)ΔH=+67.8kJ/mol;
③適量的N2和O2完全反應,每生成標準狀況下11.2L NO時,則吸收45kJ的熱量,則CH4催化還原NO的熱化學反應方程式為。
(3)已知A(g)+B(g)?C(g)+D(g)ΔH,反應的平衡常數和溫度的關系如表。
則:①ΔH溫度/℃ 700 800 830 1000 1200 平衡常數 1.7 1.1 x 0.6 0.4 0。(填“>”或“=”或“<”)
②830℃時,向一個2L的密閉容器中充入0.20mol的A和0.80mol的B,反應至10s時達到平衡,測得A的轉化率為80%,計算830℃時,反應的平衡常數x=。組卷:30引用:1難度:0.5


