2022-2023學年北京市101中學高一(下)期末化學試卷(等級考)
發布:2024/7/3 8:0:9
一、(共14道小題,每小題只有一個選項符合題意,每小題3分.)
-
1.下列設備工作時,將化學能轉化為電能的是( )
A B C D 



堿性干電池 風力發電機 太陽能集熱器 燃氣灶 A.A B.B C.C D.D 組卷:36引用:2難度:0.7 -
2.下列物質中屬于含有共價鍵的強電解質的是( )
A.CH3COOH B.C2H5OH C.MgCl2 D.Na2SO4 組卷:86引用:2難度:0.8 -
3.我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程,該歷程示意圖如圖所示。
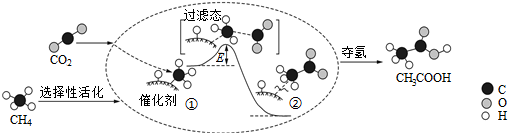
下列說法不正確的是( )A.生成CH3COOH總反應的原子利用率為100% B.CH4→CH3COOH過程中,有C-H鍵發生斷裂 C.①→②放出能量并形成了C-C鍵 D.該催化劑可有效提高反應物的平衡轉化率 組卷:134引用:36難度:0.7 -
4.下列有關原電池裝置的說法不正確的是( )

A.①、②中,鋅片都發生氧化反應 B.①、②中, 都向銅片移動SO2-4C.②可將2H++Zn═H2↑+Zn2+釋放的能量直接轉化為電能 D.當①、②中通過外電路的電子數相等時,正極生成物的質量比為32:1 組卷:69引用:3難度:0.7 -
5.某有機物的結構如圖所示,則下列說法正確的是( )

A.1mol該有機物能與2molNaOH反應 B.該有機物中有4種官能團 C.該有機物中能使酸性高錳酸鉀溶液褪色的官能團有2種 D.該有機物能發生加成反應和氧化反應,不能發生取代反應 組卷:37引用:6難度:0.7 -
6.由N2O和NO反應生成N2和NO2的能量變化如圖所示。下列說法不正確的是( )

A.反應生成1mol N2時轉移4mole- B.反應物能量之和大于生成物能量之和 C.N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol D.斷鍵吸收能量之和小于成鍵釋放能量之和 組卷:87引用:9難度:0.7
Ⅱ卷;非選擇題(共58分)
-
18.鐵及其化合物在日常生活中有廣泛應用.
(1)寫出Fe(OH)2轉化為Fe(OH)3的化學方程式.
(2)綠礬(FeSO4?7H2O)是補血劑的原料,易變質.檢驗綠礬是否變質的試劑是設計實驗檢驗綠礬是否完全變質
(3)利用綠礬制備還原鐵粉的工業流程如圖1:
①干燥過程主要是為了脫去游離水和結晶水,過程中會有少量FeCO3?nH2O在空氣中被氧化為FeOOH,該反應的化學方程式為
②取干燥后的FeCO3樣品12.49g,焙燒,最終得到還原鐵粉6.16g,計算樣品中雜質FeOOH的質量
(4)以羰基化合物為載體運用化學平衡移動原理分離、提純某納米級活性鐵粉(含有一些不反應的雜質),反應裝置如圖2.Fe(s)+5CO(g)?Fe(CO)5(g)△H<0
T1T2(填“>”、“<”或“=”),判斷理由是.組卷:38引用:3難度:0.5 -
19.已知FeCl3溶液與KI溶液的反應為可逆反應,某小組同學對該反應進行實驗探究.
(1)甲同學首先進行了實驗1.
①寫出FeCl3溶液與KI溶液反應的離子方程式實驗
1實驗步驟 實驗現象 ⅰ.取2mL 1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液3滴(1滴約為0.05mL,下同). ⅰ.溶液呈棕黃色. ⅱ.向其中滴加2滴0.1mol?L-1 KSCN溶液. ⅱ.溶液不顯紅色. .
②加入KSCN溶液的目的是.
③甲同學認為溶液不顯紅色的原因是反應體系中c(Fe3+)太低,故改進實驗方案,進行了實驗2.
本實驗改用0.1mol?L-1 KI溶液的目的是實驗
2實驗步驟 實驗現象 ⅰ.取2mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液3滴. ⅰ.溶液呈棕黃色. ⅱ.向其中滴加2滴0.1mol?L-1 KSCN溶液. ⅱ.溶液顯紅色. ⅲ.繼續加入2mL CCl4,充分振蕩、靜置. ⅲ.液體分層,上層紅色消失,變為棕黃色,下層呈紫紅色. .用化學平衡原理解釋實驗2中加入CCl4后上層溶液紅色消失的原因:.
(2)甲同學認為“用CCl4萃取后上層溶液仍為棕黃色”的原因是I2未被充分萃取,但乙同學查閱資料得到信息:I2、I3-在水中均呈棕黃色,兩者有如下關系:I2+I-?I3-.于是提出假設:萃取后的溶液呈棕黃色的主要原因是存在I3-.
①為驗證假設,乙同學設計并完成了實驗3.
實驗3的結論是實驗3 實驗步驟 實驗現象 ⅰ.取1mL實驗2中棕黃色的上層清液,再加入2mL CCl4,振蕩、靜置. ⅰ.液體分層,上層呈黃色,下層呈紫紅色. ⅱ.取1mL飽和碘水,加入2mL CCl4,振蕩、靜置. ⅱ.液體分層,上層為無色,下層呈紫紅色. .
②甲同學依據乙同學的實驗設計思路,選用實驗2中的試劑,運用控制變量的方法設計了更加嚴謹的實驗,證明了平衡I2+I-?I3-的存在.
請你補充完整他設計的實驗步驟:將實驗2中下層紫紅色溶液平均分成兩份,分裝于兩支試管中,向試管1中加入1mL水,振蕩、靜置;向試管2中.
兩支試管中的現象分別為.組卷:208引用:9難度:0.5


