2014-2015學年陜西省西安89中高二(上)化學單元測試卷
發布:2024/11/27 1:30:2
一、選擇題(本大題共18小題,每小題3分,共48分.每小題只有一個選項是符合題目要求.)
-
1.下列變化屬于吸熱反應的是( )
①液態水汽化 ②將膽礬加熱變成白色粉末 ③濃硫酸稀釋 ④氯酸鉀分解制氧氣 ⑤生石灰跟水反應生成熟石灰.A.①④ B.②③ C.①④⑤ D.②④ 組卷:139引用:55難度:0.9 -
2.下列說法正確的是( )
A.需要加熱方能發生的反應一定是吸熱反應 B.放熱的反應在常溫下一定很容易發生 C.反應是放熱還是吸熱,取決于反應物和生成物所具有的總能量的相對大小 D.伴有能量變化的物質變化都是化學變化 組卷:15引用:2難度:0.9 -
3.已知:H2(g)+F2(g)?2HF(g)△H=-270kJ/mol,下列說法正確的是( )
A.2L氟化氫氣體分解成1L的氫氣和1L的氟氣吸收270kJ熱量 B.1mol氫氣與1mol氟氣反應生成2mol液態氟化氫放出的熱量小于270kJ C.1個氫氣分子與1個氟氣分子反應生成2個氟化氫分子放出270kJ D.在相同條件下,1mol氫氣與1mol氟氣的能量總和大于2mol氟化氫氣體的能量 組卷:24引用:6難度:0.9 -
4.已知:醋酸是弱酸,其電離過程的△H>0,而強酸與強堿的稀溶液發生中和反應的熱效應:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kI/mol,向1L 0.5mol/L的NaOH溶液中加入下列物質:①稀醋酸;②濃硫酸;③稀硝酸,恰好完全反應時的反應熱△H1、△H2、△H3的關系正確的是( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2 C.△H1<△H2<△H3 D.△H1>△H3>△H2 組卷:148引用:11難度:0.9 -
5.已知膽礬溶于水時溶液溫度降低,現測定室溫下將1mol無水硫酸銅制成溶液時放出熱量為Q1kJ,又知膽礬分解的熱化學方程式為:CuSO4?5H2O(s)═CuSO4(s)+5H2O(l);△H=+Q2kJ?mol-1,則Q1、Q2關系為( )
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.無法確定 組卷:40引用:29難度:0.7 -
6.當下列反應達到平衡時,保持溫度不變,向容器中充入氬氣,平衡一定不移動的是( )
A.N2(g)+3H2(g)?2NH3(g) B.2HI(g)?H2(g)+I2(g) C.PCl5(g)?PCl3(g)+Cl2(g) D.2SO2(g)+O2(g)?2SO3(g) 組卷:68引用:19難度:0.7 -
7.對于反應A2+3B2=2C來說,以下化學反應速率的表示中,反應速率最快的是( )
A.v(B2)=0.8 mol/(L?s) B.v(A2)=0.4 mol/(L?s) C.v(C)=0.6 mol/(L?s) D.v(B2)=4.2 mol/(L?s) 組卷:146引用:102難度:0.7
二、填空題.
-
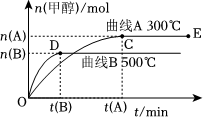 21.一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根據題意完成下列問題:
21.一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根據題意完成下列問題:
(1)反應達到平衡時,平衡常數表達式K=,升高溫度,K值(填“增大”、“減小”或“不變”),平衡向方向移動.
(2)在500℃,從反應開始到平衡,氫氣的平均反應速率v(H2)=.
(3)在其他條件不變的情況下,將處于E點的體系體積壓縮到原來的,下列有關該體系的說法正確的是12(選填選項字母).
A.氫氣的濃度減少
B.正反應速率加快,逆反應速率也加快
C.甲醇的物質的量增加
D.重新平衡時增大n(H2)n(CH3OH)
(4)據研究,反應過程中起催化作用的為Cu2O,反應體系中含少量CO2有利于維持催化劑Cu2O的量不變,原因是(用化學方程式表示).組卷:70引用:14難度:0.5 -
22.將6mol A氣體和5mol B氣體混合放入4L密閉容器中,發生下列反應:
3A(g)+B(g)?2C(g)+xD(g),經過5min達到化學平衡,此時生成C為2mol,測得D的反應速率為0.1mol/L?min,計算:
①x的值;
②平衡時B的轉化率;
③A的平衡濃度;
④求平衡常數K.(精確到小數點后兩位)組卷:16引用:3難度:0.5


