2021-2022學年江蘇省南通市、鹽城市、淮安市、宿遷市等地部分學校高一(上)第一次月考化學試卷
發布:2024/11/15 17:0:2
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.下列說法錯誤的是( )
A.只含有一種元素的物質可能是純凈物也可能是混合物 B.酸性氧化物均可跟堿起反應 C.需要通電才可進行的有:電離、電泳 D.酸根中不一定含有氧元素 組卷:215引用:2難度:0.6 -
2.下列各組物質中,按單質、化合物、混合物的順序排列的是( )
A.鐵、四氧化三鐵、冰水混合物 B.水銀、純堿、五水合硫酸銅 C.氯氣、小蘇打、純凈的空氣 D.水蒸氣、硫酸、酒精 組卷:98引用:7難度:0.8 -
3.古詩文是我們中華民族優秀傳統文化的結晶,下列詩文中沒有隱含化學變化的是( )
A.《石灰吟》:“千錘萬鑿出深山,烈火焚燒若等閑” B.《望廬山瀑布》:“飛流直下三千尺,疑是銀河落九天” C.《無題》:“春蠶到死絲方盡,蠟炬成灰淚始干” D.《酬樂天揚州初逢席上見贈》:“沉舟側畔千帆過,病樹前頭萬木春” 組卷:141引用:3難度:0.8 -
4.下列解釋事實的離子方程式正確的是( )
A.用碳酸氫鈉治療胃酸過多:CO32-+2H+=CO2↑+H2O B.用氨水吸收煙氣中的二氧化硫:SO2+2OH-=SO32-+H2O C.向硫酸氫鈉溶液中,逐滴加入Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O D.碳酸氫銨溶液中加入足量氫氧化鋇溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O 組卷:360引用:4難度:0.5 -
5.向質量分數為2a%,體積為10mL物質的量濃度為c1 mol?L-1的稀H2SO4中加入V mL的水,使之質量分數變為a%,此時物質的量濃度為c2 mol?L-1,則下列關系正確的是( )
A.V>10 2c2=c1 B.V<10 2c2>c1 C.V>10 2c2<c1 D.V>10 2c2>c1 組卷:250引用:8難度:0.7 -
6.中國詩詞中包含了豐富的化學知識,下列說法錯誤的是( )
A.梨花淡白柳深青,柳絮飛時花滿城:柳絮的主要成分屬于糖類 B.忽聞海上有仙山,山在虛無縹緲間:句中海市蜃樓形成美景的本質原因是丁達爾效應 C.火樹銀花不夜天,兄弟姐妹舞翩躚:“火樹銀花”中的焰火實質上是金屬化合物在灼燒時呈現的各種艷麗色彩 D.高堂明鏡悲白發,朝如青絲暮成雪:青絲與白發的主要成分均屬于蛋白質 組卷:114引用:3難度:0.7
二、非選擇題(共58分)
-
17.實驗室使用的純度較高的NaCl可用含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO42-等雜質的海鹽為原料制備,實驗室模擬工業制備流程如圖。
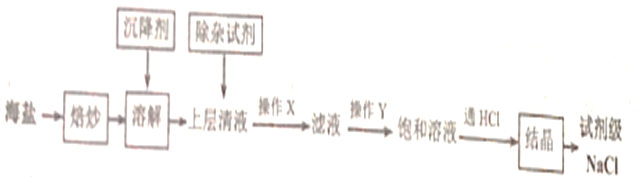
(1)焙炒海鹽的目的是。
(2)溶解時,為吸附水中的懸浮物應加入沉降劑,下列哪種沉降劑最佳。
A.明礬
B.硫酸鐵
C.硫酸鋁
D.氯化鐵
(3)操作X為。
(4)根據除雜原理,在如下表中填寫除雜時依次添加的試劑及預期沉淀的離子。
(5)用圖所示裝置,以焙炒后的海鹽為原料制備HCl氣體,并通入NaCl飽和溶液中使NaCl結晶析出。實驗步驟 試劑 預期沉淀的離子 步驟1 NaOH溶液 Mg2+、Fe3+ 步驟2 步驟3 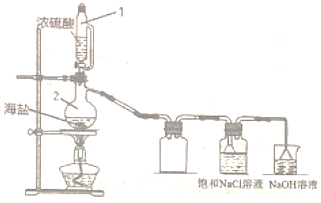
①寫出制備HCl氣體的化學反應方程式。(產物之一為正鹽)
②相比分液漏斗,選用儀器1的優點是。
③寫出儀器2的名稱。
④盛放NaOH溶液的燒杯的用途是。
(6)已知CrO42-+Ba2+═BaCrO4↓(黃色);CrO42-+3Fe2++8H+═Cr3++3Fe3++4H2O
設計如下實驗測定NaCl產品中SO42-的含量,填寫下列表格。操作 現象 目的/結論 稱取樣品m1g,加水溶解,加鹽酸調至弱酸性,滴加過量c1mol?L-1BaCl2溶液V1mL 稍顯渾濁 目的: 。繼續滴加過量c2mol?L-1K2CrO4溶液V2mL 黃色沉淀 目的:沉淀過量的Ba2+。 過濾洗滌,滴加少許指示劑于濾液中,用c3mol?L-1FeSO4溶液滴定至終點,消耗FeSO4溶液V3mL / 結論:測定SO42-的質量分數 若某次滴定,FeSO4溶液不小心濺出2滴 計算得到的SO42-的含量 。(填偏高、偏低或不變)組卷:50引用:2難度:0.5 -
18.食鹽是日常生活的必需品,也是重要的化工原料。粗食鹽常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等雜質離子,實驗室提純NaCl的流程如圖:
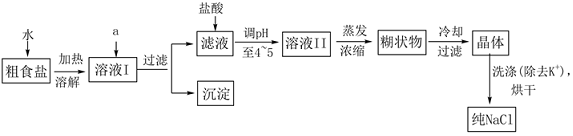
提供的試劑:飽和Na2CO3溶液、飽和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀鹽酸。
已知:NaCl在乙醇中的溶解度小于其在水中的溶解度。
(1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-離子,選出a所代表的試劑,按滴加順序依次為(只填化學式);如何判斷SO42-已除盡?。
②洗滌除去NaCl晶體表面附帶的KCl,選用的試劑為。
(2)①用提純的NaCl配制250mL 2.00mol?L-1NaCl溶液,所用儀器除天平、燒杯、藥匙、玻璃棒外還有(填儀器名稱)。
②配制該溶液時,若出現以下情況,會導致溶質的物質的量濃度偏低的是(填序號)。
a.洗凈的容量瓶未烘干
b.溶液轉移至容量瓶中后沒有洗滌燒杯
c.定容時俯視刻度線
d.發現凹液面超過了刻度線,隨即將多余的溶液吸出組卷:47引用:1難度:0.6


