2021-2022學(xué)年四川師大附屬第九實(shí)驗(yàn)中學(xué)高二(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共22小題,每小題2分,共44分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的
-
1.化學(xué)能與熱能、電能等能相互轉(zhuǎn)化,關(guān)于化學(xué)能與其他能量相互轉(zhuǎn)化的說法錯(cuò)誤的是( )
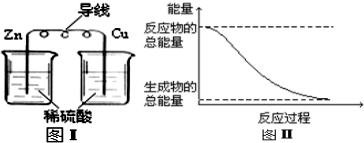
A.化學(xué)反應(yīng)中能量變化的主要原因是化學(xué)鍵的斷裂與生成 B.化石燃料是可再生性能源,燃燒時(shí)將化學(xué)能轉(zhuǎn)變?yōu)闊崮?/label> C.圖I所示的裝置不能將化學(xué)能轉(zhuǎn)變?yōu)殡娔?/label> D.圖II所示的反應(yīng)為放熱反應(yīng) 組卷:53引用:2難度:0.5 -
2.下列說法正確的是( )
A.已知2CO2(g)=2CO(g)+O2(g)反應(yīng)的ΔH=+566.0 kJ?mol-1則CO(g)的燃燒熱:ΔH=-283.0 kJ?mol-1 B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ?mol-1,則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出57.3 kJ的熱量 C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,則a>b D.已知C(石墨,s)=C(金剛石,s) ΔH>0,則金剛石比石墨穩(wěn)定 組卷:49引用:6難度:0.6 -
3.某同學(xué)設(shè)計(jì)如圖所示實(shí)驗(yàn),探究反應(yīng)中的能量變化.下列判斷正確的是( )
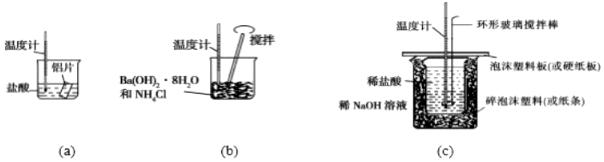
A.(a)、(b)、(c)涉及的反應(yīng)都是放熱反應(yīng) B.將實(shí)驗(yàn)(a)中的等質(zhì)量的鋁片換成鋁粉后,釋放出的總熱量有所增加 C.實(shí)驗(yàn)(c)中,將環(huán)形玻璃攪拌棒改為鐵質(zhì)攪拌棒對實(shí)驗(yàn)結(jié)果沒有影響 D.實(shí)驗(yàn)(c)中,若用NaOH固體代替NaOH溶液,測出的△H的數(shù)值偏大 組卷:16引用:4難度:0.6 -
4.下列熱化學(xué)方程式中的反應(yīng)熱下劃線處表示燃燒熱的是( )
A.NH3(g)+ O2(g)═NO(g)+54H2O(g);△H=-akJ?mol-164B.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ?mol-1 C.2CO(g)+O2(g)═2CO2(g);△H=-ckJ?mol-1 D.CH3CH2OH(l)+ O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ?mol-112組卷:194引用:10難度:0.9 -
5.下列酸與堿中和反應(yīng)熱化學(xué)方程式可用:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1來表示的是( )
A.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)ΔH=-Q1kJ?mol-1 B. H2SO4(濃)+NaOH(aq)═12Na2SO4(aq)+H2O(l)ΔH=-Q2kJ?mol-112C.HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)ΔH=-Q3kJ?mol-1 D.H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+H2O(l)ΔH=-Q4kJ?mol-1 組卷:7引用:1難度:0.5 -
6.利用固體表面催化工藝進(jìn)行NO分解的過程如圖所示。下列說法不正確的是( )

A.該分解過程是:2NO N2+O2催化劑B.實(shí)驗(yàn)室制取NO可以用銅與稀硝酸反應(yīng) C.過程②釋放能量,過程③吸收能量 D.標(biāo)準(zhǔn)狀況下,NO分解生成5.6L N2轉(zhuǎn)移電子數(shù)約為6.02×1023 組卷:143引用:8難度:0.6 -
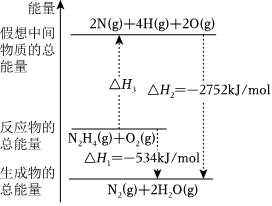 7.肼(H2N-NH2)是一種高能燃料,有關(guān)化學(xué)反應(yīng)的能量變化如圖所示,已知斷裂1mol化學(xué)鍵所需的能量(kJ):N≡N為942、O=O為500、N-N為154,則斷裂1molN-H鍵所需的能量(kJ)是( )
7.肼(H2N-NH2)是一種高能燃料,有關(guān)化學(xué)反應(yīng)的能量變化如圖所示,已知斷裂1mol化學(xué)鍵所需的能量(kJ):N≡N為942、O=O為500、N-N為154,則斷裂1molN-H鍵所需的能量(kJ)是( )A.194 B.391 C.516 D.658 組卷:2780引用:90難度:0.7 -
8.燃燒a g乙醇(液態(tài))生成CO2氣體和液態(tài)H2O放出熱量為Q kJ,經(jīng)測定a g乙醇與足量Na反應(yīng)能生成H25.6L(標(biāo)準(zhǔn)狀況),則乙醇燃燒的熱化學(xué)方程式正確的是( )
A.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H=-Q kJ?mol-1 B.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H=- Q kJ?mol-112C. C2H5OH(l)+12O2(g)→CO2(g)+32H2O(l)△H=+Q kJ?mol-132D.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H=-2Q kJ?mol-1 組卷:13引用:3難度:0.9 -
9.已知:H2O(g)═H2O(l)△H1=-Q1kJ?mol-1(Q1>0)
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(Q3>0)
依據(jù)蓋斯定律,若使23g液態(tài)乙醇完全燃燒并恢復(fù)至室溫,則放出的熱量為(單位:kJ)( )A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3) C.0.5Q1-1.5Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3 組卷:541引用:24難度:0.7
二、填空題(請把最簡答案填寫在答題卡相應(yīng)位置。共5小題,滿分56分)
-
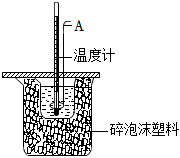 26.實(shí)驗(yàn)室測定中和熱的步驟如下(如圖)
26.實(shí)驗(yàn)室測定中和熱的步驟如下(如圖)
第一步:量取40.0mL 0.25mol/LH2SO4液倒入小燒杯中,測量溫度;
第二步:量取40.0mL 0.55mol/NaOH溶液,測量溫度;第三步:
將NaOH溶液倒入小燒杯中,混合均勻后測量混合液溫度。請回答:
(1)圖中儀器A的名稱是。
(2)NaOH溶液稍過量的原因。
(3)加入NaOH溶液的正確操作是(填字母).
A.沿玻璃棒緩慢加入B.分三次均勻加入 C.一次迅速加入D.用滴定管小心滴加
(4)上述實(shí)驗(yàn)測得的結(jié)果與理論上的57.3kJ/mol有偏差,其原因可能是.
a.NaOH溶液倒入盛有硫酸的小燒杯中后未及時(shí)將蓋板蓋好.
b.實(shí)驗(yàn)裝置保溫、隔熱效果不好
c.用溫度計(jì)測定NaOH溶液起始溫度后又直接測定H2SO4溶液的溫度
(5)若實(shí)驗(yàn)中若改用60mL 0.50mol/L的鹽酸與50mL 0.55mol/L的氫氧化鈉溶液進(jìn)行反應(yīng),與上述實(shí)驗(yàn)相比,所放出的熱量(填“相等”“不相等”),若實(shí)驗(yàn)操作均正確,則所求中和熱(填“相等”“不相等”)。組卷:10引用:1難度:0.6 -
27.某實(shí)驗(yàn)小組利用KMnO4酸性溶液與H2C2O4溶液反應(yīng)研究影響反應(yīng)速率的因素。設(shè)計(jì)實(shí)驗(yàn)方案如下(實(shí)驗(yàn)中所用KMnO4溶液均已加入H2SO4):通過測定KMnO4溶液褪色所需時(shí)間的多少來比較化學(xué)反應(yīng)速率。為了探究KMnO4與H2C2O4濃度對反應(yīng)速率的影響,某同學(xué)在室溫下完成以下實(shí)驗(yàn)。
(1)該反應(yīng)的離子方程式為實(shí)驗(yàn)編號 1 2 3 4 水/mL 10 5 0 X 0.5mol/LH2C2O4/mL 5 10 10 5 0.2mol/LKMnO4/mL 5 5 10 10 時(shí)間/S 40 20 10 - 。
(2)X=,4號實(shí)驗(yàn)中始終沒有觀察到溶液褪色,你認(rèn)為可能的原因是。
(3)2號反應(yīng)中,H2C2O4的反應(yīng)速率為。
(4)在實(shí)驗(yàn)中發(fā)現(xiàn)高錳酸鉀酸性溶液和草酸溶液反應(yīng)時(shí),開始一段時(shí)間反應(yīng)速率較慢,溶液褪色不明顯;但不久突然褪色,反應(yīng)速率明顯加快。某同學(xué)認(rèn)為是放熱導(dǎo)致溶液溫度升高所致,重做3號實(shí)驗(yàn),測定過程中溶液不同時(shí)間的溫度,結(jié)果如下表。
結(jié)合實(shí)驗(yàn)?zāi)康呐c表中數(shù)據(jù),你得出的結(jié)論是時(shí)間/S 0 5 10 15 20 25 30 溫度/℃ 25 26 26 26 26.5 27 27 。
(5)從影響化學(xué)反應(yīng)速率的因素看,你的猜想還可能是的影響。若用實(shí)驗(yàn)證明你的猜想,除了酸性高錳酸鉀溶液和草酸溶液外,還需要選擇的試劑最合理的是。(填字母)
a.硫酸鉀
b.水
c.二氧化錳
d.硫酸錳組卷:25引用:6難度:0.6


