2021年湖北省十一校聯考高考化學第二次聯考試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一個選項是符合題目要求的。
-
1.化學與生產、生活密切相關。下列說法不正確的是( )
A.我國成功研制出多款新冠疫苗,采用冷鏈運輸疫苗,以防止蛋白質變性 B.北斗衛星導航系統由中國自主研發、獨立運行,其所用芯片的主要成分為SiO2 C.5G技術的發展,推動了第三代半導體材料氮化鎵等的應用,鎵為門捷列夫所預測的“類鋁”元素 D.石墨烯液冷散熱技術系我國華為公司首創,所使用材料石墨烯是一種二維碳納米材料 組卷:64引用:5難度:0.7 -
2.下列化學用語表示錯誤的是( )
A.甲烷的比例模型: 
B.苯分子的實驗式:CH C.溴乙烷的電子式: 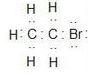
D.聚氯乙烯的鏈節:CH2=CHCl 組卷:17引用:2難度:0.8 -
3.用下列裝置進行相應實驗,能達到實驗目的的是( )
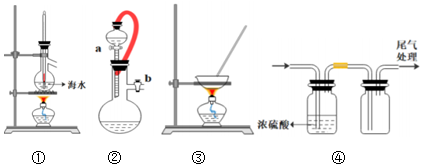
A.實驗室用裝置①制取蒸餾水 B.向分液漏斗中加適量水,關閉b、打開a,檢查裝置②的氣密性 C.用裝置③蒸干FeCl3溶液制備無水FeCl3固體 D.裝置④可用于干燥并收集SO2氣體 組卷:27引用:1難度:0.5 -
4.下列說法錯誤的是( )
A.水汽化和水分解的變化過程中,都需要破壞共價鍵 B.CaC2、Na2O2晶體中的陰、陽離子個數比分別為1:1、1:2 C.基態碳原子核外有三種能量不同的電子 D.區分晶體Ni和非晶體Ni最可靠的科學方法是X-射線衍射法 組卷:42引用:1難度:0.7 -
5.下列過程中,沒有發生氧化還原反應的是( )
A.鋁熱反應 B.皂化反應 C.銀鏡反應 D.置換反應 組卷:13引用:1難度:0.8 -
6.醋酸纖維是以醋酸和纖維素為原料制得的人造纖維,因具有彈性好、不易起皺、酷似真絲等優點,是目前市場上廣泛采用的一種服裝面料。下列有關說法正確的是( )
A.纖維素和淀粉的化學式相同,它們互為同分異構體 B.纖維素和淀粉水解,其最終產物不相同 C.[(C6H7O2)(OOCCH3)3]n--三醋酸纖維素屬于酯類化合物 D.三醋酸纖維素比二醋酸纖維素吸濕性更好 組卷:84引用:3難度:0.6
二、非選擇題:本題共4小題,共55分。
-
18.煤的綜合利用包括煤的干餾、煤的氣化、煤的液化等。煤的氣化用于生產各種氣體燃料,有利于提高煤的利用效率和環境保護,以水煤氣為原料可以得到多種有機物;煤的液化產品將替代目前的石油,最常見的液化方法是煤生產CH3OH,CH3OH對優化終端能源結構具有重要的戰略意義。
(1)煤的直接甲烷化反應為C(s)+2H2(g)?CH4(g)△H=-75.6kJ?mol-1,在不同含金催化劑條件下的反應歷程如圖所示。
催化煤的直接甲烷化效果較好的催化劑是(填“AuF”或“AuPF3+”),該反應在(填“高溫”或“低溫”)下自發進行。
(2)煤的液化可以合成甲醇。已知“氣化”:C(s)+2H2O(g)═CO2(g)+2H2(g)△H1=+90.1kJ?mol-1
催化液化Ⅰ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
催化液化Ⅱ:CO2(g)+2H2(g)═CH3OH(g)+O2(g)△H3=akJ?mol-112
則反應C(s)+H2O(g)+H2(g)═CH3OH(g)△H=kJ?mol-1
(3)一定溫度時,以水煤氣為原料合成甲醇的反應CO(g)+2H2(g)?CH3OH(g)的平衡常數為Kp=4.80×10-2kPa-2,向恒容容器中充入2mol H2和1mol CO,反應達平衡狀態時,甲醇的分壓p(CH3OH)=3.0kPa,則平衡時,混合氣體中CH3OH的物質的量分數為%。(計算結果保留一位小數,Kp是用平衡分壓代替平衡濃度所得的平衡常數,分壓=總壓×物質的量分數)
(4)燃煤煙氣脫硫的方法有多種。其中有種方法是用氨水將SO2轉化為NH4HSO3,再氧化成(NH4)2SO4。
已知常溫下亞硫酸的電離常數Ka1=1.5×10-2,Ka2=1.0×10-7,一水合氨的電離常數為Kb=1.8×10-7。
①向混合液中通空氣氧化的離子反應方程式:。
②關于NH4HSO3溶液,下列說法正確的是:。
A.NH4HSO3溶液呈酸性是因為NH4HSO3═NH4++H++SO32-
B.NH4HSO3溶液中c(NH4+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
C.NH4HSO3溶液中c(NH4+)+c(NH3H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
D.NH4HSO3溶液中c(HSO3-)>c(NH4+)>c(H2SO3)>c(SO32-)>c(H+)
③常溫下,若溶液中=0.15時,溶液的pH=c(SO2-3)c(H2SO3)。組卷:65引用:1難度:0.3 -
19.碲是一種重要的戰略稀散元素,被譽為“現代工業的維生素”,是制造光電、半導體、制冷等元件不可缺少的關鍵材料。大冶有色冶煉廠以銅陽極泥為原料,設計了如下新工藝提取、回收并制備高純碲:

[25℃時,PbSO4和PbCO3的Ksp分別為1.6×10-5(mol?L-1)2、7.4×10-14(mol?L-1)2]
(1)寫出冶煉廠電解精煉銅的陰極電極反應式。
(2)分銅陽極泥(含PbSO4)與Na2CO3混合“濕法球磨”,PbSO4可轉化為PbCO3,此反應的化學方程式為。采用“球磨”工藝有利于反應順利進行的原因是。
(3)分鉛陽極泥經硫酸化焙燒蒸硒,產生的煙氣中含SeO2與SO2。煙氣在低溫區用水吸收可回收硒,此過程中氧化劑和還原劑物質的量之比為。
(4)分硒陽極泥鹽酸浸出液中Te4+用SO2還原可以得到單質碲,發生反應的方程式為:SO2+H2O═H2SO3、。研究表明,Cl-離子濃度為0.1mol?L-1時的活化能比Cl-離子濃度為0.3mol?L-1時的活化能大,說明較高濃度Cl-可作該反應的。
(5)整個工藝路線中可以循環利用的物質有(填化學式)、。組卷:28引用:2難度:0.6


