2020年北京市人大附中高考化學三模試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.2020年5月1日北京市在全市范圍內開展施行垃圾分類,下列垃圾分類不正確的是( )
A.魚骨菜葉 B.消毒劑及其包裝物 C.破損的易拉罐 D.破碎玻璃 



廚余垃圾 有害垃圾 可回收垃圾 有害垃圾 A.A B.B C.C D.D 組卷:33引用:2難度:0.7 -
2.下列表示不正確的是( )
A.次氯酸的電子式 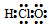
B.丁烷的球棍模型 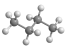
C.乙烯的結構簡式CH2=CH2 D.原子核內有8個中子的碳原子 C146組卷:385引用:12難度:0.8 -
3.下列說法不正確的是( )
A.植物油氫化過程中發生了加成反應 B.苯和甲苯都能發生取代反應 C.氯乙烯和乙醛都能用來合成高分子化合物 D.變質的油脂有難聞的特殊氣味,是由于油脂發生了水解反應 組卷:70引用:1難度:0.5 -
4.設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.10g的2H216O含有的質子數與中子數均為5NA B.32g硫在足量的氧氣中充分燃燒,轉移電子數為6NA C.26gC2H2與C6H6混合氣體中含C-H鍵的數目為2NA D.120gNaHSO4和KHSO3的固體混合物中含有的陽離子數為NA 組卷:549引用:2難度:0.7 -
5.下列反應的離子方程式正確的是( )
A.向Ca(ClO)2溶液中通入過量CO2制次氯酸:2ClO-+H2O+CO2═2HClO+CO32- B.[Ag(NH3)2]OH與足量鹽酸反應生成AgCl:[Ag(NH3)2]++OH-+3H++Cl-═AgCl↓+2NH4++H2O C.Cl2與熱的NaOH溶液反應制取NaClO3:2Cl2+6OH-═3Cl-+ClO3-+3H2O D.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O 組卷:64引用:2難度:0.6 -
6.CO甲烷化反應為:CO(g)+3H2(g)═CH4(g)+H2O(l)。如圖是使用某種催化劑時轉化過程中的能量變化(部分物質省略),其中步驟②反應速率最慢。下列說法不正確的是( )
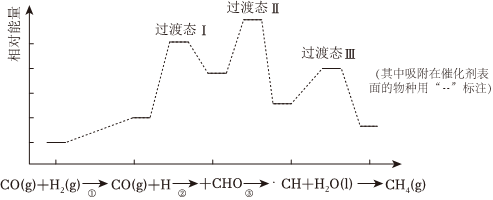
A.步驟①只有非極性鍵斷裂 B.步驟②速率最慢的原因可能是其活化能最高 C.步驟③需要吸收熱量 D.使用該催化劑不能有效提高CO的平衡轉化率 組卷:326引用:11難度:0.5
二、解答題(共5小題,滿分58分)
-
18.今年6月比亞迪正式發布刀片電池,大幅度提高了電動汽車的續航里程可媲美特斯拉,刀片電池采用磷酸鐵鋰技術。可利用鈦鐵礦【主要成分為FeTiO3(難溶性亞鐵鹽),還含有少量MgO等雜質】來制備LiFePO4和Li4Ti5O12等鋰離子電池的電極材料,工藝流程如圖。
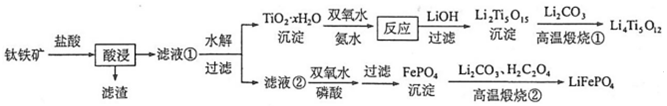
回答下列問題:
(1)“酸浸”后,鈦主要以TiOCl42-形式存在,寫出相應反應的離子方程式。
(2)TiO2?xH2O沉淀與雙氧水、氨水“反應”轉化成(NH4)2Ti5O15溶液時,Ti元素的浸出率與反應溫度的關系如圖所示。反應溫度過高時,Ti元素浸出率變化的原因是。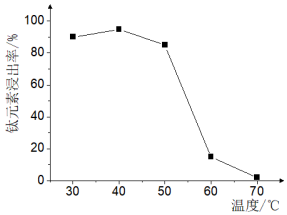
(3)“濾液②”中含有的金屬離子是;加入雙氧水和磷酸使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol?L-1,此時溶液中c(PO4)3=。(FePO4的Ksp=1.3×10)-22
(4)寫出“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式。
(5)Li2Ti5O15中Ti的化合價為+4,其中過氧鍵的數目為。
(6)作為刀片電池正極材料的磷酸鐵鋰在充、放電時的局部放大示意圖如圖,則正極電極反應式是。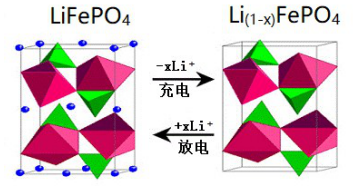 組卷:43引用:1難度:0.3
組卷:43引用:1難度:0.3 -
19.某校化學小組同學研究Cu與H2SO4溶液反應,小偉同學實驗記錄如表。
(1)實驗一:探究白霧的成分。實驗編號 實驗操作 實驗現象 Ⅰ 取螺旋狀銅絲在酒精燈上燒至紅熱,迅速伸入裝有10mL 3mol/L H2SO4溶液的試管中 產生大量白霧;溶液顏色變為淺藍色;試管中出現紅色渾濁 Ⅱ 步驟一:取螺旋狀銅絲在酒精燈上燒至紅熱,迅速伸入裝有10mL蒸餾水的試管中;步驟二:冷卻后加入5mL 3mol/L H2SO4 步驟一:產生少量白霧;試管中出現黑色渾濁,略帶紅色步驟二:渾濁全部為紅色;溶液略顯藍色
①波波同學收集實驗Ⅰ中白霧,加入品紅溶液,溶液褪色,得出結論:白霧成分包含SO2.可能是因為局部溫度過高產生,寫出有關化學方程式。
②艷艷同學認為不妥,補充實驗Ⅲ:
根據實驗Ⅲ,可推斷白霧成分是實驗編號 實驗操作 實驗現象 Ⅲ 步驟一:取品紅溶液,加3mol/L H2SO4
溶液,加熱;
步驟二:收集實驗Ⅰ中白霧,加入品紅溶液,加熱。步驟一:溶液褪色,加熱無顏色變化;步驟二:溶液褪色,加熱無顏色變化 ,而并非SO2。
(2)實驗二:探究紅色固體的成分。
經過分析,實驗Ⅰ和實驗Ⅱ中的紅色渾濁成分相同。
【資料】Cu2O能溶在濃氨水中形成無色Cu(NH3)2+,很容易被氧氣氧化為藍色Cu(NH3)42+;
Cu2O能與一定濃度的酸溶液發生反應:Cu2O+2H+═Cu2++Cu+H2O。
①寫出Cu2O溶在濃氨水中的離子方程式。
②對于紅色渾濁的成分,谷哥設計實驗并證實了紅色固體中只有Cu2O.他的實驗是:將實驗Ⅰ試管中固體過濾洗滌,得紅色固體。
③結合實驗Ⅰ和Ⅱ,吉吉同學確定銅絲燒至紅熱時生成了。
(3)實驗三:探究紅色固體不溶的原因。
經過檢驗,實驗Ⅰ和實驗Ⅱ反應后的溶液均顯酸性,對于體系中有Cu2O固體的原因:龍校假設:在實驗條件下,隨著溶液酸性降低,Cu2O與酸無法反應。
喬博假設:在實驗條件下,隨著溶液酸性降低,Cu2O與酸反應速率變小。鄒鄒同學繼續實驗:
①實驗Ⅴ的目的是實驗編號 實驗操作 實驗現象 Ⅳ 取Cu2O固體少量,加入到裝有10mL 3mol/L H2SO4溶液的試管中 溶液迅速變為藍色;試管中出現少量亮紅色固體 Ⅴ 取Cu2O固體少量,加入到裝有10mL 3mol/L H2SO4和少量CuSO4(淺藍色)的試管中
現象同ⅣⅥ 重復實驗Ⅰ,振蕩試管,分為兩等份。第一份立刻加入濃硫酸至c(H2SO4)=3mol/L;第二份靜置4h之后,過濾,向固體中加入濃硫酸至c(H2SO4)=3mol/L 第一份加酸后紅色固體明顯減少,溶液藍色加深;第二份靜置時,固體減少,溶液緩慢變為藍色,固體加酸后無明顯現象。 。
②通過以上實驗,臧臧同學得出的結論是。組卷:49引用:1難度:0.5


