2021年江蘇省高考化學猜題試卷
發布:2024/11/8 16:0:3
一、選擇題:本題共10小題,每小題3分,共42分。每小題只有一個選項符合題目要求。
-
1.華夏文明源遠流長,以下說法從化學視角理解錯誤的是( )
A.“日照澄洲江霧開,淘金女伴滿江隈”,詩中的“霧”可產生丁達爾效應 B.“甘之如飴”,說明糖類均有甜味 C.“凡石灰,經火焚煉為用”,這段記載中涉及分解反應 D.“百寶都從海舶來,玻璃大鏡比門排”,制普通玻璃的某成分可用于制造光導纖維 組卷:24引用:1難度:0.8 -
2.用化學用語表示C2H2+HCl
C2H3Cl(氯乙烯)中的相關微粒,其中正確的是( )HgCl2150~160℃A.中子數為7的碳原子: C76B.氯乙烯的結構簡式:CH2CHCl C.氯離子的結構示意圖: 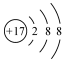
D.HCl的電子式: 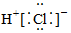 組卷:68引用:14難度:0.7
組卷:68引用:14難度:0.7 -
3.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.4 +5HCHO+12H+═4Mn2++5CO2↑+11H2O,1mol[4MnO-4+5HCHO]完全反應轉移的電子數為20NAMnO-4B.用電解粗銅的方法精煉銅,當電路中通過的電子數為NA時,陽極應有32g Cu轉化為Cu2+ C.常溫下,pH=9的CH3COONa溶液中,水電離出的H+數為10-5NA D.1L濃度為0.100mol?L-1的Na2CO3溶液中,陰離子數為0.100NA 組卷:798引用:7難度:0.5 -
4.對于如圖所示實驗,下列實驗現象預測或操作正確的是( )

A.實驗甲:勻速逐滴滴加鹽酸時,試管中沒氣泡產生和有氣泡產生的時間段相同 B.實驗乙:充分振蕩后靜置,下層溶液為橙紅色,上層為無色 C.實驗丙:由MgCl2?6H2O制備無水MgCl2 D.裝置丁:酸性KMnO4溶液中有氣泡出現,且溶液顏色會逐漸變淺乃至褪去 組卷:32引用:2難度:0.5
二、非選擇題:本題共4小題,共58分。
-
17.為測定CuSO4溶液的濃度,甲、乙兩同學設計了兩個方案。回答下列問題:
Ⅰ.甲方案
實驗原理:CuSO4+BaCl2═BaSO4↓+CuCl2
實驗步驟: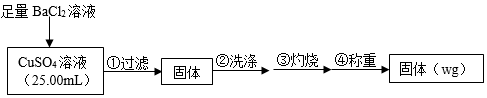
(1)判斷沉淀完全的操作為SO2-4。
(2)步驟②判斷沉淀是否洗凈所選用的試劑為。
(3)步驟③灼燒時盛裝樣品的儀器名稱為。
(4)固體質量為wg,則c(CuSO4)=mol?L-1。
(5)若步驟①從燒杯中轉移沉淀時未洗滌燒杯,則測得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
Ⅱ.乙方案
實驗原理:Zn+CuSO4═ZnSO4+Cu
Zn+H2SO4═ZnSO4+H2↑
實驗步驟:
①按如圖安裝裝置(夾持儀器略去)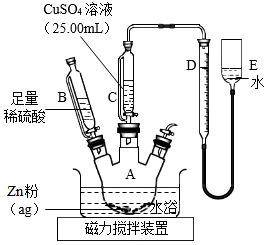
②……
③在儀器A、B、C、D、E中加入如圖所示的試劑
④調整D、E中兩液面相平,使D中液面保持在0或略低于0刻度位置,讀數并記錄
⑤將CuSO4溶液滴入A中并攪拌,反應完成后,再滴加稀硫酸至體系不再有氣體產生
⑥待體系恢復到室溫,移動E管,保持D、E中兩液面相平,讀數并記錄
⑦處理數據
(6)步驟②為。
(7)步驟⑥需保證體系恢復到室溫的原因是(填序號)。
a.反應熱受溫度影響
b.氣體密度受溫度影響
c.反應速率受溫度影響
(8)Zn粉質量為ag,若測得H2體積為bmL,已知實驗條件下ρ(H2)=dg?L-1,則c(CuSO4)=mol?L-1(列出計算表達式)。
(9)若步驟⑥E管液面高于D管,未調液面即讀數,則測得c(CuSO4)(填“偏高”、“偏低”或“無影響”)。
(10)是否能用同樣的裝置和方法測定MgSO4溶液的濃度:(填“是”或“否”)。組卷:818引用:6難度:0.5 -
18.甲醇不僅是重要的化工原料,還是性能優良的能源和車用燃料。
(1)H2(g)和CH3OH(l)的燃燒熱分別為285.8kJ?mol-1和726.5kJ?mol-1,則由CO2(g)和H2(g)生成液態甲醇和液態水的熱化學方程式為。
(2)CO與H2也可以合成CH3OH,已知CO和H2可以利用如下反應制備:CH4(g)+H2O?CO(g)+3H2(g)△H>0,一定條件下CH4的平衡轉化率與溫度、壓強的關系如圖1所示。T1T2(填“<”、“>”或“=”);A、B、C三點處對應平衡常數(KA、KB、KC)的大小關系為。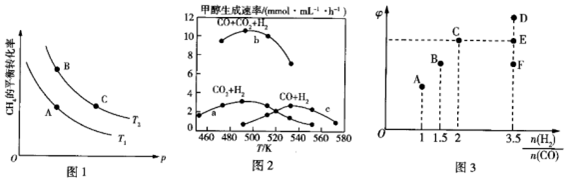
(3)已知Ⅰ.CO(g)+H2O(g)?CO2(g)+H2(g),Ⅱ.CO(g)+2H2(g)?CH3OH(g),Ⅲ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。如圖2為一定比例的CO2、H2,CO、H2,CO、CO2、H2三個反應體系下甲醇生成速率與溫度的關系。
①490K時,根據曲線a、c判斷合成甲醇的反應機理是。(填“A”或“B”)
A.CO2COH2H2OCH3OHH2
B.COCO2H2OH2CH3OH+H2OH2
②490K時,曲線a與曲線b相比,CO的存在使甲醇生成速率增大,結合反應Ⅰ、Ⅲ分析原因:。
(4)在T1℃時,向體積為2L的恒容容器中充入物質的量之和為3mol的H2和CO,發生反應CO(g)+2H2(g)?CH3OH(g),達到平衡時CH3OH的體積分數φ與起始時的關系如圖3所示。n(H2)n(CO)
①當起始時=2,反應經過5min達到平衡,若此時CO的轉化率為0.6,則0~5min內平均反應速率v(H2)=n(H2)n(CO)。若此時再向容器中充入CO(g)和CH3OH(g)各0.4mol,達新平衡時H2的轉化率將。(填“增大”、“減小”或“不變”)
②當起始時=3.5,反應達到平衡狀態后,CH3OH的體積分數可能對應圖3中的n(H2)n(CO)(填“D”“E”或“F”)點。組卷:65引用:3難度:0.4


