2022-2023學年貴州省貴陽市清華中學高二(上)月考化學試卷(11月份)
發布:2024/9/22 3:0:20
一、選擇題(14小題,每小題3分,共42分.每小題只有一個選項最符合題意)
-
1.核酸檢測管中浸泡咽拭子的紅色溶液是加入了酚紅鈉鹽指示劑(變色pH如圖)的病毒保存液。如果該試樣因非必要細菌增殖而變質(已知細菌繁殖會產生CO2;飽和碳酸濃度為0.03mol?L-1;lg6=0.78),核酸檢測管中溶液變質后最不可能表現出什么顏色( )

A.紫紅色 B.黃色 C.棕黃 D.橙色 組卷:6引用:1難度:0.5 -
2.為除去MgCl2酸性溶液中的Fe3+,可在加熱攪拌的條件下加入的一種試劑是( )
A.NH3?H2O B.NaOH C.Na2CO3 D.MgCO3 組卷:30引用:5難度:0.9 -
3.已知:Ag2SO4微溶于水,Ag2SO3難溶于水。對Ag2SO3飽和溶液改變下列條件,可使
減小,同時c(Ag+)增大的是( )c(SO2-3)A.常溫下,加入少量蒸餾水 B.常溫下,加入少量Na2SO3 C.常溫下,通入少量O2,氧化 SO2-3D.由常溫降低至10℃ 組卷:1引用:1難度:0.7 -
4.室溫下,往0.001mol?L-1的氨水中滴入幾滴酚酞試液時,溶液呈現粉紅色。現采取下列措施,其中能使滴有酚酞的氨水溶液顏色變淺的是( )
A.往溶液中加入0.1mol?L-1的氨水 B.往溶液中加入CH3COONH4晶體 C.往溶液中加入CH3COONa固體 D.往溶液中加入0.001mol?L-1NaOH溶液 組卷:249引用:3難度:0.6 -
5.下列方程式書寫正確的是( )
A.NaHCO3?Na++H++ CO2-3B.CH3COO-+H2O?CH3COOH+OH- C.H2SO4?2H++ SO2-4D.CaCO3?Ca2++ CO2-3組卷:5引用:1難度:0.5 -
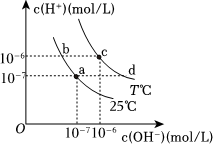 6.在不同溫度下,水溶液中c(H+)與c(OH-)有如圖所示關系。下列說法正確的是( )
6.在不同溫度下,水溶液中c(H+)與c(OH-)有如圖所示關系。下列說法正確的是( )A.d點對應的溶液中若只含有Na2CO3,則存在c(Na+)>c( )>c(OH-)>c(CO2-3)>c(H+)HCO-3B.a點對應的溶液中可能大量存在:Fe3+、Na+、Cl-、 NO-3C.c點pH=6,該水溶液呈酸性 D.b點對應的溶液中可能大量存在:K+、Fe2+、 、I-NO-3組卷:4引用:1難度:0.6
第Ⅱ卷;非選擇題(共58分)
-
18.電離平衡常數是衡量弱電解質電離程度大小的量,已知部分物質的電離常數如表所示,請回答下列有關問題.
(1)向一定濃度的Na2CO3溶液滴入酚酞的現象為化學式 電離平衡常數(25℃) HClO Ka=3.0×10-8 CH3COOH Ka=1.8×10-5 H2CO3 Ka1=4.3×10-7、Ka2=5.6×10-11 H2C2O4 Ka1=5.6×10-2、Ka2=1.5×10-4 NH3?H2O Kb=1.8×10-5 ,請用離子方程式解釋原因:.
(2)25℃時,等濃度的①NaClO溶液,②Na2CO3溶液,③CH3COONa溶液,三種溶液的pH值由大到小的順序為(用序號表示).
(3)下列微粒可以大量共存的是.
A.、CH3COOHCO2-3
B.、HClOHCO-3
C.H2CO3、ClO-
D.H2C2O4、HCO-3
(4)體積均為10mL、pH=2的醋酸溶液與某一元酸a分別加水稀釋至1000mL,稀釋過程pH變化如圖: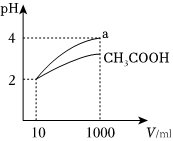
在體積、pH均相同的CH3COOH與某一元酸a中加入足量的鋅,生成的氫氣在標準狀況下的體積大小關系:CH3COOH某酸a(填“>”、“<”或“=”).
(5)高氯酸、硫酸的酸性不同,但在水溶液中難于區分他們的酸性強弱,因為二者在水溶液中均完全電離,但是在冰醋酸中能夠區分,已知硫酸在冰醋酸中部分電離,請寫出硫酸在冰醋酸中的電離方程式:.組卷:7引用:1難度:0.6 -
19.高品質MnO2可用于生產鋰離子電池正極材料錳酸鋰.以軟錳礦與黃鐵礦為主要原料采用“兩礦一步浸出法”制備高品質MnO2的某工藝流程如圖所示:
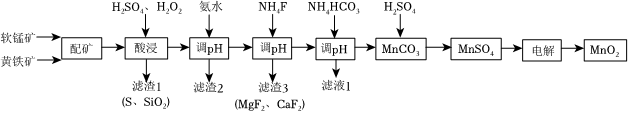
已知:①軟錳礦與黃鐵礦的主要成分為MnO2、FeS2,還含少量FeO、Fe2O3、MgO、Al2O3、SiO2等雜質;
②該工藝條件下,相關金屬離子完全形成氫氧化物沉淀的pH如下:
回答下列問題:金屬離子 Fe2+ Fe3+ Mn2+ Mg2+ Al3+ 開始沉淀pH 6.9 1.9 6.6 9.1 3.4 沉淀完全(c=1.0×10-5mol?L-1)的pH 8.3 3.2 10.1 10.9 4.7
(1)“配礦”過程中,將軟錳礦與黃鐵礦粉碎混勻的目的是.
(2)“酸浸”操作中需先后分批加入H2SO4、H2O2.加入H2SO4后發生酸浸過程的主要反應離子方程式為2FeS2+3MnO2+12H+═2Fe3++3Mn2++4S↓+6H2O,2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O.
①已知濾渣1的主要成分為S、SiO2等,其附著在礦粉顆粒表面使上述反應受阻,此時加入H2O2,利用其迅速分解產生的大量氣泡可破除該不利影響.分析導致H2O2迅速分解的因素是.
②礦粉顆粒表面附著物被破除后,H2O2可繼續與MnO2在酸性條件下反應,產生更多Mn2+,并伴有氣體生成,該反應的離子方程式是.
③H2O2除上述作用外,還可以將溶液中未與MnO2反應的Fe2+轉化為Fe3+,其目的是:.
(3)“調pH”時調節溶液pH范圍為4.7~6.0,此時“濾渣2”的主要成分為(填化學式).
(4)“用NH4F除雜”時,溶液體系中的Ca2+和Mg2+形成氟化物沉淀.若沉淀后上層清液中c(F-)=c(F2)=0.05mol/L,則=c(Ca2+)c(Mg2+)[已知Ksp(MgF2)=5.0×10-11,Ksp(CaF2)=2.5×10-9].組卷:11引用:1難度:0.4


