2020-2021學年江西省吉安市高三(上)期末化學試卷
發布:2024/12/23 2:0:2
一、選擇題(本題包括16個小題,每小題只有一個選項符合題意,每小題3分,共48分)
-
1.化學與生產、生活、科技、環境等密切相關。下列說法正確的是( )
A.秸稈經加工處理制成吸水性的材料--植物纖維,可用作食品干燥劑 B.“天宮一號”使用的碳纖維,是一種新型有機高分子材料 C.醫用雙氧水和酒精均可用于新冠病毒防疫消毒和傷口清洗,二者消毒原理相同 D.純堿既可用于清洗油污,也可用于治療胃酸過多 組卷:14引用:1難度:0.6 -
2.下列說法正確的是( )
A.H、D、T的原子核外電子排布相同 B.H2、D2、T2互為同素異形體 C.18g H2O與20g D2O中質子數與中子數均為10NA D.氕、氘發生核聚變后成為其他元素的變化屬于化合反應 組卷:38引用:1難度:0.8 -
3.下列指定反應的離子方程式正確的是( )
A.用醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O B.KClO堿性溶液與Fe(OH)3反應:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+4H++H2O C.向硫酸鋁溶液中滴加碳酸鈉溶液:2Al3++3CO32-═Al2(CO3)3↓ D.電解飽和食鹽水獲取燒堿和氯氣:2Cl-+2H2O H2↑+Cl2↑+2OH-電解組卷:30引用:1難度:0.8 -
4.設NA為阿伏加德羅常數的值,下列敘述不正確的是( )
A.0.1mol14C中,含有0.8NA個中子 B.含NA個CO32-的Na2CO3溶液中,Na+數目大于2NA C.一定條件下,將1mol N2與3mol H2充入一密閉容器內充分反應后,容器內氣體分子數小于2NA D.向含有FeI2的溶液中通入適量氯氣,當有1mol Fe2+被氧化時,反應中轉移電子的數目至少為3NA 組卷:26引用:2難度:0.5 -
5.下列說法不正確的是( )
A.2-苯基丙烯(  )能使稀高錳酸鉀溶液褪色
)能使稀高錳酸鉀溶液褪色B.異丙苯(  )的沸點比苯高
)的沸點比苯高C.化合物  (b)、
(b)、 (d)、
(d)、 (p)中,只有b和d分子的所有原子分別處于同一平面
(p)中,只有b和d分子的所有原子分別處于同一平面D.將甲醛水溶液與氨水混合蒸發可制得烏洛托品(  ),反應中消耗甲醛與氨的物質的量之比應為3:2組卷:30引用:1難度:0.5
),反應中消耗甲醛與氨的物質的量之比應為3:2組卷:30引用:1難度:0.5 -
6.下列有關物質用途的說法中不正確的是( )
A.生石灰用作食品抗氧化劑 B.用活性炭除去冰箱中的異味 C.Al2O3熔點高,可用作耐高溫材料 D.小蘇打是面包發酵粉的主要成分 組卷:48引用:1難度:0.8 -
7.壽山石M4[N4Y10(YX)8]是我國四大印章石之首,被稱為國石。壽山石由X、Y、M、N四種原子序數依次增大的短周期元素組成,M元素是地殼中含量最高的金屬元素,N元素的單質常用來制造太陽能電池,X3Y+和YX-含有相同的電子數,下列說法正確的是( )
A.原子半徑X<Y<M<N B.簡單氫化物的穩定性Y<N C.含M的一種鹽常用于凈水消毒 D.壽山石可用簡單化合物形式表示為2M2Y3?4NY2?4X2Y 組卷:18引用:2難度:0.5
二、非選擇題(本題包括5個小題,共52分)
-
20.NiSO4?6H2O是一種綠色易溶于水的晶體,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素的化合物雜質)為原料獲得。操作步驟如圖。
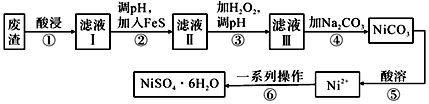
(1)為提高廢渣的浸出率,可采取的措施是、(答2點);“酸浸”與“酸溶”兩步所使用的酸相同,為。(填化學式)
(2)步驟②中加入FeS固體是為了生成更難溶于水的硫化物沉淀而除去Cu2+、Zn2+等雜質,則除去Cu2+的離子方程式為。
(3)步驟③中加入足量的H2O2,理由是。調節濾液Ⅱ的pH,可除去的金屬離子是。
(4)濾液Ⅲ中加入Na2CO3過濾后得到NiCO3固體,檢驗Ni2+已完全沉淀的實驗方法是。
(5)④⑤兩步操作的目的是。
(6)經過“一系列操作”可得到NiSO4?6H2O晶體,其中具體操作包括、、過濾、洗滌、干燥等。如果得到產品的純度不夠,則還應該進行操作。(填序號)
a.蒸餾
b.分液
c.重結晶
d.過濾組卷:6引用:1難度:0.6 -
 21.研究處理NOx、SO2對環境保護有著重要的意義。回答下列問題:
21.研究處理NOx、SO2對環境保護有著重要的意義。回答下列問題:
(1)二氧化硫在一定條件下可以發生如下反應:SO2(g)+NO2(g)?SO3(g)+NO(g)ΔH=-42kJ?mol-1。在固定體積的密閉容器中,使用某種催化劑,改變原料氣配比進行多組實驗(各組實驗的溫度可能相同,也可能不同),測定NO2的平衡轉化率[α(NO2)]。部分實驗結果如圖所示。n0(NO2)n0(SO2)
①如果要將圖中C點對應的平衡狀態改變為B點對應的平衡狀態,則應采取的措施是。
②若A點對應實驗中,SO2(g)的起始濃度為c0mol?L-1,經過tmin達到平衡狀態,則該時段化學反應速率v(NO2)=mol?L-1?min-1。
③圖中C、D兩點對應的實驗溫度分別為TC和TD,通過計算判斷:TCTD。(填或“<”、“=”或“<”)
(2)2NO(g)+O2(g)?2NO2(g)的反應歷程如下:
反應Ⅰ:2NO(g)?N2O2(g)(快)ΔH1<0v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
反應Ⅱ:N2O2(g)+O2(g)?2NO2(g)(慢)ΔH2<0v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
一定條件下,反應2NO(g)+O2(g)?2NO2(g)達到平衡狀態,平衡常數K=(用含k1正、k1逆、k2正、k2逆的代數式表示)。反應Ⅰ的活化能EⅠ(填“>”、“<”或“=”)反應Ⅱ的活化能EⅡ。
②已知反應速率常數k隨溫度升高而增大,則升高溫度后k2正增大的倍數k2逆增大的倍數。(填“>”“<”或“=”)
(3)用測壓法在剛性密閉容器中研究T℃時4NO(g)?N2(g)+2NO2(g)的分解反應,現將一定量的NO充入該密閉容器中,測得體系的總壓強隨時間的變化如表所示。
①20min時,NO的轉化率α=反應時間/min 0 10 20 30 40 壓強/MPa 15.00 14.02 13.20 12.50 12.50 。
②T℃時,4NO(g)?N2(g)+2NO2(g)反應的平衡常數Kp=。(Kp為以分壓表示的平衡常數)組卷:31引用:2難度:0.4


