2021-2022學年云南省曲靖市宣威三中高二(下)月考化學試卷(4月份)
發布:2024/11/28 4:0:2
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一個是符合題目要求的。
-
1.以下是中華民族為人類文明進步做出巨大貢獻的幾個事例,運用化學知識對其進行的分析不合理的是( )
A.漢代燒制出“明如鏡、聲如磬”的瓷器,其主要原料為黏土 B.商代后期鑄造出工藝精湛的后(司)母戊鼎,該鼎屬于銅合金制品 C.四千余年前用谷物釀造出酒和醋,釀造過程中只發生水解反應 D.屠呦呦用乙醚從青蒿中提取出對治療瘧疾有特效的青蒿素,該過程包括萃取操作 組卷:115引用:23難度:0.6 -
2.NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.2.4g Mg在足量O2中燃燒,轉移的電子數為0.1NA B.標準狀況下,5.6L CO2氣體中含有的氧原子數為0.5NA C.氫原子數為0.4NA的CH3OH分子中含有的σ鍵數為0.4NA D.0.1L 0.5mol/L CH3COOH溶液中含有的H+數為0.05NA 組卷:3416引用:9難度:0.9 -
3.O2F2可以發生反應:H2S+4O2F2→SF6+2HF+4O2,下列說法正確的是( )
A.氧氣是氧化產物 B.O2F2既是氧化劑又是還原劑 C.若生成4.48LHF,則轉移0.8mol電子 D.還原劑與氧化劑的物質的量之比為1:4 組卷:425引用:89難度:0.7 -
4.下列有關物質性質與用途具有對應關系的是( )
A.NaHCO3受熱易分解,可用于制胃酸中和劑 B.SiO2熔點高硬度大,可用于制光導纖維 C.Al2O3是兩性氧化物,可用作耐高溫材料 D.CaO能與水反應,可用作食品干燥劑 組卷:922引用:19難度:0.9 -
5.根據SO2通入不同溶液中實驗現象,所得結論不正確的是( )
實驗 現象 結論 A 含HCl、BaCl2的FeCl3溶液 產生白色沉淀 SO2有還原性 B H2S溶液 產生黃色沉淀 SO2有氧化性 C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性 D Na2SiO3溶液 產生膠狀沉淀 酸性:H2SO3>H2SiO3 A.A B.B C.C D.D 組卷:2871引用:62難度:0.8 -
6.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - B. =1×10-12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)C.c(Fe2+)=1mol?L-1的溶液中:K+、NH4+、MnO4-、SO42- D.能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3- 組卷:2933引用:36難度:0.7
二、非選擇題:本題包括15、16、17和18共4個題,共58分。
-
17.丙烯是重要的有機化工原料,丙烷脫氫是工業生產丙烯的重要途徑,其化學方程式為C3H8(g)?C3H6(g)+H2(g)。
回答下列相關問題:
(1)已知:Ⅰ.2C3H8(g)+O2(g)?2C3H6(g)+2H2(g)△H1=-238kJ?mol-1
Ⅱ.2H2(g)+O2(g)?2H2O(g)△H2=-484kJ?mol-1
則丙烷脫氫制丙烯反應C3H8(g)?C3H6(g)+H2(g)的△H為kJ?mol-1
(2)一定溫度下,向1L的密閉容器中充入1molC3H8發生脫氫反應,經過10min達到平衡狀態,測得平衡時氣體壓強是開始的1.5倍。
①0~10min丙烯的化學反應速率v(C3H6)=mol?L-1?min-1。
②下列情況能說明該反應達到平衡狀態的是(填字母標號)。
A.△H不變
B.C3H6與H2的物質的量之比保持不變
C.混合氣體的總壓強不變
D.c(C3H6)正=c(C3H6)逆
③欲提高丙烷轉化率,采取的措施是(填字母標號)。
A.降低溫度
B.升高溫度
C.加催化劑
D.及時分離出H2
④若在恒溫、恒壓的密閉容器中充入丙烷和氬氣發生脫氫反應,起始n(氬氣)/n(丙烷)越大,丙烷的平衡轉化率越大,其原因是。
(3)一定溫度下,向恒容密閉容器中充入1molC3H8,開始壓強為pkPa,C3H8的氣體體積分數與反應時間的關系如圖所示: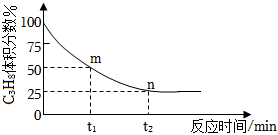
①此溫度下該反應的平衡常數Kp=(用含字母p的代數式表示,Kp是用反應體系中氣體物質的分壓表示的平衡常數,平衡分壓=總壓×體積分數)。
②已知該反應過程中,v正=k正p(C3H8),v逆=k逆p(C3H6)p(H2),其中k正、k逆為速率常數,只與溫度有關,則圖中m點處=v正v逆。組卷:9引用:3難度:0.4 -
 18.東晉《華陽國志?南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品.回答下列問題:
18.東晉《華陽國志?南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品.回答下列問題:
(1)鎳元素基態原子的電子排布式為,3d能級上的未成對電子數為.
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液.
①[Ni(NH3)6]SO4中陰離子的立體構型是.
②在[Ni(NH3)6]SO4中Ni2+與NH3之間形成的化學鍵稱為,提供孤電子對的成鍵原子是.
③氨的沸點(填“高于”或“低于”)膦(PH3),原因是;氨是分子(填“極性”或“非極性”),中心原子的軌道雜化類型為.
(3)單質銅及鎳都是由鍵形成的晶體;元素銅與鎳的第二電離能分別為:ICu=1958kJ?mol-1、INi=1753kJ?mol-1,ICu>INi的原因是.
(4)某鎳白銅合金的立方晶胞結構如圖所示.
①晶胞中銅原子與鎳原子的數量比為.
②若合金的密度為d g?cm-3,晶胞參數a=nm.組卷:2088引用:16難度:0.3


