2021-2022學年安徽省六安一中高二(上)期末化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題3分,共48分,每小題僅有一個最佳答案)
-
1.以下有關元素性質的說法不正確的是( )
A.具有下列電子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半徑最大的是① B.具有下列價電子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4 第一電離能最大的是③ C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的電負性隨原子序數(shù)增大而遞增的是④ D.某元素氣態(tài)基態(tài)原子的逐級電離能(kJ?mol-1)分別為738、1451、7733、10540、13630、17995、21703,當它與氯氣反應時可能生成的陽離子是X3+ 組卷:103引用:8難度:0.9 -
2.用短線“-”表示共用電子對,用“‥”表示未成鍵孤對電子的式子叫路易斯結構式.R分子的路易斯結構式可以表示為
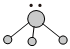 ,則以下敘述錯誤的是( )
,則以下敘述錯誤的是( )A.R為三角錐形 B.R可以是BF3 C.R是極性分子 D.鍵角小于109°28′ 組卷:66引用:12難度:0.9 -
 3.正硼酸(H3BO3)是一種片層狀結構的白色晶體,層內的H3BO3分子之間通過氫鍵相連(層狀結構如圖所示,圖中“虛線”表示氫鍵)。下列有關說法正確的是( )
3.正硼酸(H3BO3)是一種片層狀結構的白色晶體,層內的H3BO3分子之間通過氫鍵相連(層狀結構如圖所示,圖中“虛線”表示氫鍵)。下列有關說法正確的是( )A.H3BO3分子的穩(wěn)定性與氫鍵有關 B.含1molH3BO3的晶體中有3mol氫鍵 C.分子中B、O最外層均為8e-穩(wěn)定結構 D.B原子雜化軌道的類型為sp2,同層分子間的主要作用力是范德華力 組卷:84引用:1難度:0.5 -
4.X、Y、Z、Q、E、M六種元素中,X的原子的基態(tài)價電子排布式為2s2,Y的基態(tài)原子核外有5種運動狀態(tài)不同的電子,Z元素的兩種同位素原子通常作為示蹤原子研究生物化學反應和測定文物的年代,Q是元素周期表中電負性最大的元素,E的陽離子通常存在于硝石、明礬和草木灰中,M的原子序數(shù)比E大1.下列說法正確的是( )
A.EYQ4 中陰離子中心原子的雜化方式為sp3雜化 B.X、Y元素的第一電離能大小關系:X<Y C.ZO32-的空間構型為V形 D.MZ2含離子鍵和非極性共價鍵,陰陽離子之比為1:2 組卷:50引用:4難度:0.5 -
5.已知以下反應中的四種物質由三種元素組成,其中a的分子立體構型為正四面體形,組成a物質的兩種元素的原子序數(shù)之和小于10,組成b物質的元素為第三周期元素。下列判斷正確的是( )
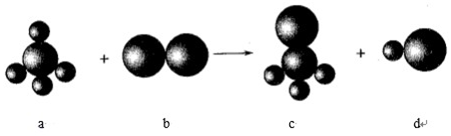
A.四種分子中的化學鍵均是極性鍵 B.a(chǎn)、c分子中中心原子均采用sp3雜化 C.四種分子中既有σ鍵,又有π鍵 D.b、d 分子中共價鍵的鍵能:b>d 組卷:122引用:7難度:0.5 -
6.從結構角度分析,下列說法錯誤的是( )
A.I3+的立體構型為V形,中心原子的雜化方式為sp3 B.ZnCO3中,陰離子立體構型為平面三角形,C原子的雜化方式為sp2 C.因HF分子間存在氫鍵,所以HX中其沸點最高 D.二氧化硅中硅,氧原子都是為sp3雜化,是極性分子 組卷:157引用:5難度:0.7 -
7.價層電子對互斥理論(VSEPR)是關于分子幾何構型的經(jīng)驗規(guī)律,該理論認為,分子的穩(wěn)定結構應使中心原子價層電子對之間的斥力最小,且不同價層電子對之間排斥力相對大小滿足:孤對電子-孤對電子>孤對電子-鍵對電子>鍵對電子-鍵對電子。如H2O分子中∠H-O-H≈104.5°,下列推斷不合理的是( )
A.NH3分子中∠H-N-H<109.5° B.H2O鍵角∠H-O-H小于H3O+鍵角∠H-O-H C.已知P4分子為正四面體,P4O6中的∠O-P-O小于P4O10中的∠O-P-O D.[Zn(NH3)6]2+離子中∠H-N-H小于NH3分子中∠H-N-H 組卷:73引用:4難度:0.6
二、填空題(每空2分,共52分)
-
20.SO2可用于制Na2S2O3.為探究某濃度的Na2S2O3的化學性質,某同學設計如圖1實驗流程:
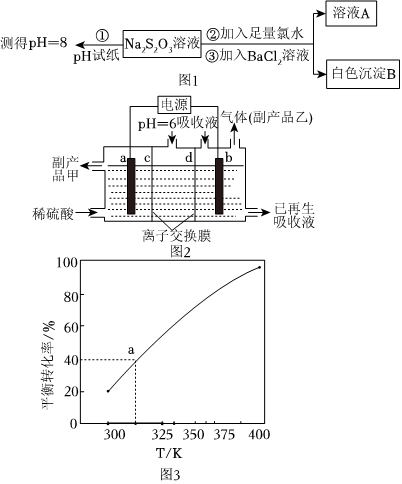
(1)用離子方程式表示Na2S2O3溶液具有堿性的原因.Na2S2O3與氯水反應的離子方程式是.
(2)含SO2的煙氣可用Na2SO3溶液吸收.可將吸收液送至電解槽再生后循環(huán)使用.再生電解槽如圖2所示.a(chǎn)電極上含硫微粒放電的反應式為.(任寫一個).離子交換膜(填標號)為陰離子交換膜.
(3)2SO3(g)?2SO2(g)+O2(g),將一定量的SO3放入恒容的密閉容器中,測得其平衡轉化率隨溫度變化如圖3所示.圖中a點對應溫度下,已知SO3的起始壓強為P0,該溫度下反應的平衡常數(shù)KP=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數(shù)).組卷:6引用:1難度:0.6 -
21.三鹽基硫酸鉛(3PbO?PbSO4?H2O,其相對分子質量為990)簡稱“三鹽”,不溶于水及有機溶劑。主要適用于不透明的聚氯乙烯硬質管、注射成型制品,也可用于人造革等軟質制品。以鉛泥(主要成分為PbO、Pb及PbSO4等)為原料制備三鹽的工藝流程如圖所示。
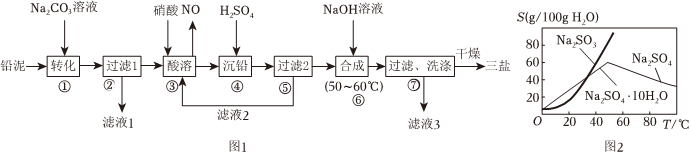
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13
請回答下列問題:
(1)寫出步驟①“轉化”的離子方程式。
(2根據(jù)圖2溶解度曲線(g/100g水),由濾液1得到Na2SO4固體的操作為:將“濾液1”、
用乙醇洗滌后干燥。
(3)步驟③“酸溶”,為提高酸溶速率,可采取的措施是(任意寫出一條)
(4)“濾液2”中可循環(huán)利用的溶質為(填化學式)。若步驟④“沉鉛”后的濾液中c(Pb2+)=1.82×10-5mol?L-1,則此時c()=SO2-4mol?L-1。
(5)步驟⑥“合成”三鹽的化學方程式為
(6)若消耗100.0t鉛泥,最終得到純凈干燥的三鹽49.5t,假設鉛泥中的鉛元素有75%轉化為三鹽,則鉛泥中鉛元素的質量分數(shù)為。組卷:77引用:6難度:0.6


