2021-2022學年天津市五校聯(lián)考高三(上)期中化學試卷
發(fā)布:2024/11/24 16:30:2
一.本卷共12題,每題3分,共36分。在每題給出的四個選項中,只有一項是最符合題目要求的。
-
1.2021年4月29日,中國空間站核心艙“天和號”成功送入預(yù)定軌道,它與化學有著密切聯(lián)系。下列說法錯誤的是( )
A.中國空間站推進器的推進劑氙氣(Xe)屬于稀有氣體 B.“天和號”推進器的氮化硼陶瓷基材料屬于新型無機非金屬材料 C.宇航服材料中的聚氯乙烯屬于有機高分子材料 D.空間站太陽能電池板的主要材料屬于硅酸鹽 組卷:68引用:6難度:0.9 -
2.下列化學用語表述正確的是( )
A.S2Cl2結(jié)構(gòu)式為Cl-S-S-Cl B.S2-結(jié)構(gòu)示意圖為 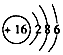
C.PCl3電子式為: 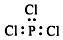
D.CO2分子的比例模型: 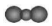 組卷:35引用:2難度:0.7
組卷:35引用:2難度:0.7 -
3.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.能溶解Al(OH)3的溶液:Ca2+、Na+、HCO3-、NO3- B.0.1mol?L-1KOH溶液:AlO2-、Na+、I-、SO42- C.能使pH試紙顯深紅色的溶液:Fe3+、Cl-、Ba2+、SCN- D.0.1mol?L-1NaClO溶液:HS-、Na+、Cl-、CO32- 組卷:36引用:1難度:0.7 -
4.下列說法正確的是( )
A.不可以用氨水鑒別AlCl3溶液和AgNO3溶液 B.SO2有漂白性因而可使品紅溶液、溴水褪色. C.向KI淀粉溶液中加入FeCl3溶液,溶液變藍說明Fe3+能與淀粉發(fā)生顯色反應(yīng) D.ClO2具有強氧化性,可以用于自來水殺菌消毒 組卷:38引用:2難度:0.7 -
5.設(shè)NA為阿伏加德羅常數(shù)的值。下列說法正確的是( )
A.71gCl2與足量水反應(yīng),轉(zhuǎn)移的電子數(shù)目為2NA B.標準狀況下,22.4L15NH3含有的質(zhì)子數(shù)目為10NA C.常溫下,pH=13的NaOH溶液中OH-數(shù)目為0.1NA D.78gNa2O2晶體所含陰陽離子的總數(shù)為4NA 組卷:72引用:2難度:0.5
二、解答題(共4小題,滿分64分)
-
15.海水中含有大量的鹵族元素,具有十分巨大的開發(fā)利用潛力。
Ⅰ.氯氣是非常重要的化工產(chǎn)品
(1)用濃鹽酸和二氧化錳制氯氣是實驗室常用的方法,寫出該反應(yīng)的化學方程式:。
(2)也可用濃鹽酸和高錳酸鉀制氯氣,反應(yīng)方程式如下:2KMnO4+16HCl(濃)═KCl+2MnCl2+5Cl2↑+8H2O。實驗室用該方法制氯氣時,可選用的發(fā)生裝置是(寫編號)。
(3)為證明氯氣與水反應(yīng)產(chǎn)物具有漂白性,將Cl2緩緩通過下列裝置:編號 A B C 發(fā)生裝置 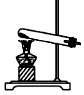
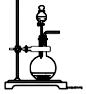
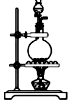
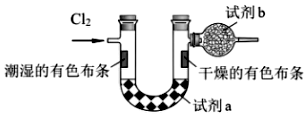
試劑a應(yīng)選擇;
試劑b的作用是;。
(4)通常使用84消毒液時需要把消毒對象在其中浸泡一段時間,以提高消毒效果。請結(jié)合反應(yīng)方程式分析原因。
Ⅱ.地球上99%的溴元素以Br-形式存在于海水中。海水中Br-含量約為65mg/L,而苦鹵(海水曬鹽后得到的母液)中Br-含量高很多,苦鹵常作海水提溴的主要原料。目前最成熟的“空氣吹出法”海水提溴工藝流程如圖(已知:溴的沸點為59℃):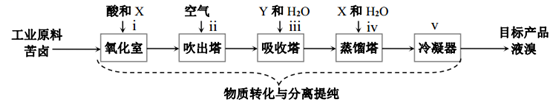
(5)為實現(xiàn)Br-轉(zhuǎn)化為Br2的目的,所加試劑X應(yīng)必有的化學性質(zhì)是。
(6)利用“空氣吹出法”將“氧化室”產(chǎn)生的低濃度Br2分離出來的方法利用了溴的這一物理性質(zhì)。
(7)將低濃度Br2富集為高濃度Br2歷經(jīng)步驟iii反應(yīng)的離子方程式為:。組卷:47引用:2難度:0.7 -
16.自然界中的局部氮循環(huán)如圖。
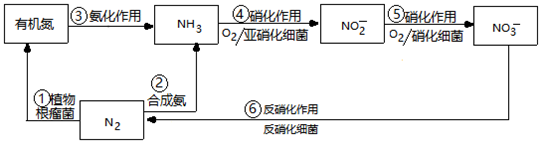
(1)上圖含氮物質(zhì)的各步轉(zhuǎn)化中,屬于氮的固定的是(填數(shù)字序號)。
(2)NH3是氮循環(huán)中的重要物質(zhì),工業(yè)合成氨反應(yīng)的化學方程式為。
(3)某化工廠出現(xiàn)泄漏大量氨水進入循環(huán)水系統(tǒng),使循環(huán)水中含氯殺菌劑(有效成分為Cl2)的殺菌效果降低、硝化作用增強,導致循環(huán)水的pH發(fā)生波動,最終造成設(shè)備腐蝕。
①下列有關(guān)氨對循環(huán)水影響的說法中,正確的是(填字母序號)。
a.過量氨進入循環(huán)水后,水中NO2-和NO3-含量會升高
b.過量氨進入循環(huán)水后,不會導致水體富營養(yǎng)化
c.循環(huán)水pH的波動中,pH的上升與氨水的堿性有關(guān)
②通過檢測循環(huán)水中的c(NO2-)可判斷循環(huán)水的水質(zhì)是否惡化,c(NO2-)檢測利用的是酸性條件下I-被NO2-氧化為I2的反應(yīng),該反應(yīng)的歷程如下:
Ⅰ.NO2-+2H+=NO++H2O
Ⅱ.……
Ⅲ.2ONI=I2+2NO
Ⅱ的離子方程式為。
(4)汽車排出的尾氣中也含有氮氧化物,如果直接排放到大氣中可能造成,為避免污染,常給汽車安裝三元催化凈化裝置,氮氧化物和CO在催化劑作用下生成無毒可直接排放的物質(zhì)。以NO2為例寫出凈化過程中的總化學方程式:。
(5)含NO3-的廢水可用二硫化亞鐵(FeS2)處理,在反硝化細菌的作用下發(fā)生以下反應(yīng),請將離子方程式補充完整:14NO3-+5FeS2+H+7N2↑+10SO42-+反硝化細菌+H2O組卷:18引用:1難度:0.6


