2016-2017學(xué)年河南省洛陽(yáng)市回民中學(xué)高二(上)開(kāi)學(xué)化學(xué)試卷
發(fā)布:2024/11/13 5:30:2
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.下列分子中存在π鍵的是( )
A.H2 B.Cl2 C.N2 D.HCl 組卷:102引用:12難度:0.9 -
2.下列離子方程式的書(shū)寫(xiě)正確的是( )
A.SO2使酸性KMnO4褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ B.Fe(OH)2與HNO3溶液的反應(yīng):Fe(OH)2+2H+=Fe2++2H2O C.足量NaOH與磷酸二氫銨反應(yīng):OH-+NH4+=NH3?H2O D.將SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+ 組卷:4引用:1難度:0.9 -
3.溶液、膠體和濁液這三種分散系的根本區(qū)別是( )
A.是否是大量分子或離子的集合體 B.是否能通過(guò)濾紙 C.分散質(zhì)粒子直徑的大小 D.是否均一、透明、穩(wěn)定 組卷:378引用:32難度:0.9 -
4.鍵能為破壞1mol化學(xué)鍵所需要吸收的能量或形成1mol化學(xué)鍵所放出的能量.已知H-H的鍵能為436kJ/mol,H-Cl的鍵能為432kJ/mol,氫氣與氯氣反應(yīng)時(shí)放出熱量.據(jù)此判斷,下列說(shuō)法不正確的是( )
A.H2分子比H原子更穩(wěn)定 B.可求出Cl-Cl 的鍵能為428 kJ/mol C.1mol氫氣與1mol氯氣所含的總能量比2mol HCl所含的總能量高 D.理論上利用此反應(yīng)制取鹽酸的同時(shí),可依據(jù)原電池原理獲取電能 組卷:161引用:2難度:0.7 -
5.下列說(shuō)法錯(cuò)誤的是( )
A.硅是良好的半導(dǎo)體材料 B.氨氣與硝酸合成氮肥屬于人工固氮 C.金剛石、石墨和富勒烯互為同素異形體 D.硬鋁、青銅和不銹鋼都屬于合金 組卷:13引用:2難度:0.9 -
6.下列說(shuō)法正確的是( )
A.乙烯和聚乙烯均能使溴水褪色 B.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 C.乙酸和乙酸乙酯均能發(fā)生取代反應(yīng) D.葡萄糖與果糖、淀粉與纖維素分子式相同,均互為同分異構(gòu)體 組卷:10引用:3難度:0.9 -
7.下列用于解釋實(shí)驗(yàn)事實(shí)的化學(xué)方程式正確的是( )
A.Al2(SO4)3溶液滴加氨水產(chǎn)生白色膠狀沉淀:Al3++3OH-=Al(OH)3↓ B.純堿溶液使酚酞變紅:CO32-+2H2O?H2CO3+2OH- C.乙酸清除水垢后的化學(xué)反應(yīng)原理:2H++CO32-=CO2↑+H2O D.FeCl3溶液中加入足量鐵粉,溶液由黃色變成淺綠色:2Fe3++Fe=3Fe2+ 組卷:2引用:1難度:0.7
二、解答題
-
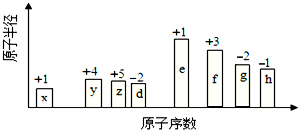 22.隨原子序數(shù)的遞增的八種短周期元素(用字母X表示)原子半徑的相對(duì)大小、最高正價(jià)或最低負(fù)價(jià)的變化如圖所示.
22.隨原子序數(shù)的遞增的八種短周期元素(用字母X表示)原子半徑的相對(duì)大小、最高正價(jià)或最低負(fù)價(jià)的變化如圖所示.
根據(jù)判斷出的元素回答問(wèn)題:
(1)f 在元素周期表的位置是;g的離子結(jié)構(gòu)示意圖為.
(2)在z、d、e、f 四種元素中,其離子半徑按由大到小的排列順序?yàn)?!--BA-->(用
化學(xué)式表示,下同);比較g、h的最高價(jià)氧化物對(duì)應(yīng)的水化物的酸性較強(qiáng)的是:.
(3)由x和z元素組成一種四原子共價(jià)化合物,寫(xiě)出其電子式.
(4)由x、z、h三種元素構(gòu)成的鹽,其水溶液顯酸性,用離子方程式解釋其原因.
(5)已知1mol e 的單質(zhì)在足量d2中燃燒,恢復(fù)至室溫,放出255.5kJ熱量,寫(xiě)出該反應(yīng)的熱化學(xué)方程式:.組卷:15引用:2難度:0.5 -
23.A、B、C、D是短周期元素形成的四種氣體單質(zhì).E、F均為氣體,且F為紅棕色.有關(guān)的轉(zhuǎn)化關(guān)系如圖所示(反應(yīng)條件均已略去).請(qǐng)回答下列問(wèn)題:
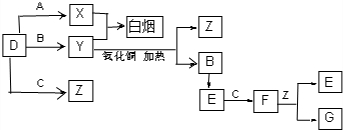
(1)B的電子式為,E的化學(xué)式為.
(2)寫(xiě)出實(shí)驗(yàn)室制備Y化學(xué)反應(yīng)方程式為.
(3)Y和F在一定條件下可反應(yīng)生成兩種無(wú)毒無(wú)污染的物質(zhì),這是一個(gè)具有實(shí)際意義的反應(yīng),可消除F對(duì)環(huán)境的污染,該反應(yīng)的化學(xué)方程式為.組卷:9引用:2難度:0.3


