2020-2021學年山東省德州實驗中學高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題2分,共30分。每小題只有一個選項符合題意)
-
1.下列說法不正確的是( )
A.丙烯的結構簡式:CH2CHCH3 B.[TiCl(H2O)5]Cl2?H2O的配合物內界和外界Cl-的數目之比是1:2 C.2-甲基丁烷的鍵線式: 
D.基態鈉原子的軌道表示式:  組卷:11引用:1難度:0.5
組卷:11引用:1難度:0.5 -
2.下列說法錯誤的是( )
A. C表示質子數為6、中子數為8的核素146B.液化石油氣的主要成分C3H8、C4H10與蘋果表面的蠟狀物質二十七烷一定互為同系物 C.醫學上研究發現 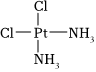 具有抗癌作用,而
具有抗癌作用,而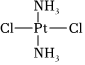 沒有抗癌作用,說明兩者互為同分異構體,都是以Pt原子為中心的平面結構
沒有抗癌作用,說明兩者互為同分異構體,都是以Pt原子為中心的平面結構D.C5H11Cl的同分異構體有8種,其沸點均相同 組卷:53引用:5難度:0.7 -
3.氨分子得到一個H+,變成銨離子(
)。下列對上述過程的描述不合理的是( )NH+4A.氮原子的雜化類型發生了改變 B.微粒的形狀發生了改變 C.微粒的化學性質發生了改變 D.微粒中的鍵角發生了改變 組卷:36引用:7難度:0.7 -
4.下列有關描述正確的是( )
A.熔點:Na<K<Al B.無機含氧酸的酸性:H2SO3<H2SO4<HClO4 C.電負性:F>N>O D.基態Cr原子的價電子排布圖:  組卷:22引用:2難度:0.9
組卷:22引用:2難度:0.9 -
5.當地時間2020年1月30日晚,世界衛生組織(WHO)宣布,將新型冠狀病毒疫情列為國際關注的突發公共衛生事件,防疫專家表示,75%的醫用酒精、含氯消毒劑(如84消毒液等)可以有效殺滅病毒,同時出行佩戴口罩能有效減少感染新冠的危險。下列有關說法正確的是( )
A.制作口罩的原料之一丙烯分子中碳原子采取sp2、sp3雜化 B.乙醇可以和水以任意比互溶的原因只是因為兩者均為極性分子,相似相溶 C.次氯酸的電子式: 
D.乙醇分子中官能團為羥基,1mol羥基含有10NA個電子,能穩定存在于水溶液中 組卷:9引用:1難度:0.6 -
6.元素的原子結構決定其性質和在周期表中的位置.下列說法正確的是( )
A.按電子排布,可把周期表里的元素劃分成5個區,Zn元素屬于d區 B.多電子原子中,在離核較近的區域內運動的電子能量較高 C.P、S、Cl的電離能、電負性和最高價氧化物對應的水化物的酸性均依次增大或增強 D.這是某同學給出的Fe原子的3d能級電子排布圖: 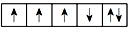 ,此排布圖違反了洪特規則組卷:23引用:7難度:0.7
,此排布圖違反了洪特規則組卷:23引用:7難度:0.7 -
 7.一水合甘氨酸鋅結構簡式如圖所示。下列說法錯誤的是( )
7.一水合甘氨酸鋅結構簡式如圖所示。下列說法錯誤的是( )A.Cu與Zn兩者晶體內金屬原子的配位數均為12 B.該物質中,Zn2+的配位數為5,配原子為O、N C.基態Zn2+價電子排布式為:3d84s2 D.電負性大小順序為:O>N>C>H>Zn 組卷:39引用:3難度:0.8 -
 8.下列關于晶體的說法正確的組合是( )
8.下列關于晶體的說法正確的組合是( )
①在晶體中只要有陰離子就一定有陽離子
②CaTiO3晶體中(晶胞結構如圖所示)每個Ti4+和12個O2-相緊鄰
③金剛石、SiC、NaF、NaCl、H2O、H2S晶體的熔點依次降低
④分子晶體中分子間作用力越大,分子越穩定
⑤SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結合
⑥離子晶體熔化時晶格能越大,熔點越高
⑦晶體狀態能導電的一定是金屬晶體A.①②③④ B.①②⑥⑦ C.②③④⑤ D.①②③⑥ 組卷:59引用:3難度:0.7
三、填空題(本題共4個題)
-
23.過渡金屬及其化合物在化工、醫藥、材料等領域有著廣泛的應用。
(1)基態鈦原子的價電子排布圖為,與鈦同周期的過渡元素中,基態原子的成對電子數與鈦相同的還有種。
(2)在濃的TiCl3的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6、組成為TiCl3?6H2O的晶體,該晶體中兩種配體的物質的量之比為2:4,則由該配合離子組成的晶體化學式還可以寫為。
(3)航母螺旋槳主要用銅合金制造。含銅廢液可以利用銅萃取劑M,通過如下反應實現銅離子的富集,進行回收。
①M所含元素的第一電離能最大的是(用元素符號表示)。
②X化合物中中心原子銅的配位數是,上述反應中斷裂和生成的化學鍵有。
(4)立方氮化硼硬度僅次于金剛石,但熱穩定性遠高于金剛石,其晶胞結構如圖所示。立方氮化硼屬于晶體。已知:立方氮化硼密度為dg?cm-3,B原子半徑為xpm,N原子半徑為ypm,阿伏加德羅常數的值為NA,則該晶胞中原子的空間利用率(晶胞中原子的體積占晶胞體積的百分率)為(列出計算式即可,不用化簡)。 組卷:11引用:2難度:0.4
組卷:11引用:2難度:0.4 -
 24.周期表中前四周期元素R、W、X、Y、Z的原子序數依次增大。R基態原子中,電子占據的最高能層符號為L,最高能級上只有兩個自旋方向相同的電子。工業上通過分離液態空氣獲得X單質。Y原子的最外層電子數與電子層數之積等于R、W、X三種元素的原子序數之和。Z基態原子的最外能層只有一個電子,其他能層均已充滿電子,請回答下列問題:
24.周期表中前四周期元素R、W、X、Y、Z的原子序數依次增大。R基態原子中,電子占據的最高能層符號為L,最高能級上只有兩個自旋方向相同的電子。工業上通過分離液態空氣獲得X單質。Y原子的最外層電子數與電子層數之積等于R、W、X三種元素的原子序數之和。Z基態原子的最外能層只有一個電子,其他能層均已充滿電子,請回答下列問題:
(1)Y原子的價電子排布式為,YX4-的立體構型是;HYX4酸性比HYX2強,其原因是。(H為氫元素,下同)
(2)結構簡式為RX(WH2)2的化合物中R原子的雜化軌道類型為;1mol RX(WH2)2分子中含有σ鍵數目為。
(3)往Z的硫酸鹽溶液中通入過量的WH3,可生成[Z(WH3)4]SO4,下列說法正確的是
A.[Z(WH3)4]SO4中所含的化學鍵有離子鍵、極性鍵和配位鍵
B.在[Z(WH3)4]2+中Z2+給出孤電子對,WH3提供空軌道
C.[Z(WH3)4]SO4組成元素中第一電離能最大的是氧元素
(4)某Y與Z形成的化合物的晶胞如圖所示(黑點代表Z原子)。
①該晶體的化學式為。
②已知Z和Y的電負性分別為1.9和3.0,則Y與Z形成的化合物屬于(填“離子”或“共價”)化合物。
③已知該晶體的密度為ρg?cm-3,阿伏加德羅常數的值為NA,則該晶體中Z原子和Y原子之間的最短距離為cm(只寫計算式)(Z原子位于體對角線上)。組卷:17引用:3難度:0.5


