2020-2021學年吉林省長春市九臺區師范高級中學高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題3分,共60分,每個小題只有一個正確選項)
-
1.化學與生產、生活、科技、環境等密切相關。下列說法錯誤的是( )
A.推廣燃煤脫硫技術可以降低SO2對大氣的污染 B.雙氧水還原后的產物為水,被稱為綠色氧化劑 C.我國提出網絡強國戰略,光纜線路總長超過三千萬公里,光纜的主要成分是硅 D.大力發展電動汽車、氫燃料電池汽車等新能源汽車有助于減少二氧化碳排放量 組卷:3引用:1難度:0.7 -
2.鋁及其化合物在生產和日常生活中有著重要的應用,下列說法中不正確的是( )
A.電解AlCl3飽和溶液,可制得金屬鋁 B.鋁熱反應不僅被用于焊接鋼軌,而且還常被用于冶煉熔點較高的金屬 C.氫氧化鋁可用于治療胃酸過多 D.Al2O3、MgO的熔點很高,可用于制作耐高溫材料 組卷:6引用:1難度:0.7 -
3.下列敘述中正確的是( )
A.維生素C可做水果罐頭中的抗氧化劑 B.淀粉是熱值最高的營養物質,在人體內直接水解生成葡萄糖 C.羊油皂化反應液中加入熱的飽和食鹽水,析出的硬脂酸鈉沉淀是肥皂的主要成分 D.在紫外線,Na2SO4溶液、CuSO4溶液,福爾馬林等的作用下,蛋白質均會發生變性 組卷:18引用:1難度:0.7 -
4.一定溫度下,在一個容積為2L的密閉容器中發生反應4A(s)+3B(g)?2C(g)+D(g),經2min達到平衡狀態,此時B反應了1.2mol,下列說法正確的是( )
A.充入N2(不參與反應)使壓強增大可加快反應速率 B.0~2min內,A的平均反應速率為0.4mol?L-1?min-1 C.平衡狀態時,B、C的反應速率相等 D.0~2min內,C的平均反應速率為0.2mol?L-1?min-1 組卷:5引用:2難度:0.5 -
 5.因新型冠狀病毒肺炎疫情防控需求,口罩已經成為了2020每個人必備之品。熔噴布,俗稱口罩的“心臟”,是口罩中間的過濾層,能過濾細菌,阻止病菌傳播。熔噴布是一種以高熔融指數的聚丙烯(PP)為材料,由許多縱橫交錯的纖維以隨機方向層疊而成的膜。其中有關聚丙烯的認識正確的是( )
5.因新型冠狀病毒肺炎疫情防控需求,口罩已經成為了2020每個人必備之品。熔噴布,俗稱口罩的“心臟”,是口罩中間的過濾層,能過濾細菌,阻止病菌傳播。熔噴布是一種以高熔融指數的聚丙烯(PP)為材料,由許多縱橫交錯的纖維以隨機方向層疊而成的膜。其中有關聚丙烯的認識正確的是( )A.由丙烯通過加聚反應合成聚丙烯 B.聚丙烯的鏈節:-CH2-CH2-CH2- C.合成聚丙烯單體丙烯的結構簡式:CH2CHCH3 D.聚丙烯能使溴水發生加成反應而褪色 組卷:35引用:6難度:0.6 -
6.圖是氮及其化合物的“價-類”二維圖,結合二維圖及氧化還原反應的基本規律,下列相關分析或預測錯誤的是( )

A.硝酸具有較強的氧化性,可用稀硝酸清洗“銀鏡實驗”后的試管 B.NO、NO2和NH3在一定條件下均能反應,可用氨氣處理氮氧化物 C.可用加熱NH4NO3的方法制取氨氣 D.聯氨(N2H4)可能被亞硝酸(HNO2)氧化生成氫疊氮酸HN3 組卷:71引用:4難度:0.6 -
 7.某小組為研究電化學原理,設計如圖裝置。下列敘述錯誤的是( )
7.某小組為研究電化學原理,設計如圖裝置。下列敘述錯誤的是( )A.a和b不用導線連接時,鐵片上會有氣泡生成 B.a和b用導線連接時,銅片上發生的反應為:2H++2e-═H2↑ C.無論a和b是否連接,鐵片均會溶解,溶液均逐漸變成淺綠色 D.a和b用導線連接時,電子由銅片通過導線流向鐵片 組卷:21引用:2難度:0.7 -
8.硫元素常見化合價及其物質類別關系如圖,下列說法錯誤的是( )

A.X是H2S B.Y既有氧化性又有還原性 C.將X與Y混合,不能生成硫 D.工業上制Z的主要原料是硫鐵礦 組卷:173引用:6難度:0.5
二、填空題(共4小題,共40分)
-
23.下表是A、B、C、D、E五種有機物的有關信息:
回答下列問題:A ①能使溴的四氯化碳溶液褪色;②比例模型為 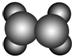 ;③能與水在一定條件反應生成C
;③能與水在一定條件反應生成CB ①由C、H兩種元素組成;
②空間充填模型為
C ①由C、H、O三種元素組成;②能與Na反應,但不能與NaOH溶液反應;③能與E反應生成相對分子質量為100的酯 D ①相對分子質量比C少2;②能由C氧化而成 E ①由C、H、O三種元素組成;
②球棍模型為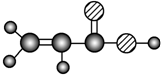
(1)A與溴的四氯化碳溶液反應的生成物的名稱是.
(2)A與氫氣發生加成反應后生成物質F,與F在分子組成和結構上相似的有機物有一大類(俗稱“同系物”),它們均符合通式CnH2n+2(n為正整數)。當n=時,這類有機物開始出現同分異構體。
(3)C與E反應能生成相對分子質量為100的酯,該反應的反應類型為;其化學方程式為。
(4)由C氧化生成D的化學方程式為。
(5)寫出有機物B的結構簡式,有機物B中(填“含有”或“不含”)含碳碳雙鍵。組卷:2引用:2難度:0.5 -
24.二氧化碳是污染大氣的主要有害物質之一,有是形成酸雨的罪魁禍首之一,從一定的程度上講,可以說與我們的生產生活有著廣泛的聯系.
(1)目前,食品行業大都采用二氧化碳漂白食品,為測定食品中殘留二氧化碳的含量,通常采用的實驗方法主要是:樣品經處理后,加入氫氧化鈉使殘留的二氧化碳以亞硫酸鹽的形式固定,在加入硫酸使二氧化硫游離,在加入碘標準溶液反應掉二氧化碳.
①寫出SO2與NaOH反應的離子方程式.
②碘與SO2反應時,為使現象明顯可通常在碘水中加入指示劑.
(2)火力發電是重要的電力來源,但是煤燃燒排放的SO2會造成一系列環境問題.有關資料提示利用海水除硫是一種有效的方法,其工藝流程如圖所示:
已知海水中主要含有Na+、K+、Ca+、Mg2+、Cl-、Br-等離子,天然海水的pH≈8,呈弱堿性.
①吸收塔內利用天然海水吸收含硫煙氣,是利用了二氧化硫的哪些性質
A.酸性氧化物 B.還原性 C.易溶于水 D.漂白性 E.氧化性
②天然海水吸收含硫煙氣體后,用氧氣進行氧化處理,其反應的離子方程式為;
③氧化后的海水需要用大量的天然海水與之混合后才能釋放,該操作的主要目的是.
(3)工業上生產硫酸時,利用催化氧化反應將SO2轉化為SO3是一個關鍵的步驟.已知某溫度下,向體積為10 L的密閉容器中加入4.0 mol SO2和10.0 mol O2,當反應達到平衡時,測得混合氣體的物質的量為13.0 mol,則SO2的轉化率為.組卷:16引用:4難度:0.9


