2022-2023學年遼寧省沈陽二中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題3分,共45分。每題只有一個正確選項)。
-
1.化學與生產生活密切相關。下列說法錯誤的是( )
A.洗滌油污常用熱的碳酸鈉溶液 B.銨態氮肥與草木灰不得混合施用 C.電解精煉銅時,粗銅做陰極 D.為除去水垢中的CaSO4,可先用Na2CO3溶液處理 組卷:10引用:1難度:0.7 -
2.下列說法正確的是( )
A.強電解質溶液的導電能力一定比弱電解質溶液的強 B.加熱條件下發生的反應均為吸熱反應 C.溶解度小的沉淀不能轉化為溶解度比其大的沉淀 D.石墨轉化為金剛石需要吸收能量,所以石墨更穩定 組卷:13引用:1難度:0.5 -
3.下列化學用語錯誤的是( )
A.NaHCO3的電離方程式:NaHCO3=Na++HCO3- B.H2(g)燃燒熱的熱化學方程式:H2(g)+ O2(g)?H2O(l) ΔH=-285.8kJ?mol-112C.Mg(OH)2(s)的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) D.S2-水解的離子方程式:S2-+2H2O?H2S+2OH- 組卷:24引用:1難度:0.5 -
4.下列說法中正確的是( )
A.在100℃時,pH約為6的純水呈酸性 B.將1mL1×10-6mol/L鹽酸稀釋至100mL,所得溶液的pH為8 C.常溫下,當水電離出的c(H+)為1×10-13mol/L時,此溶液的pH可能為1或13 D.將pH=3的鹽酸和醋酸各1mL分別稀釋至100mL,所得醋酸的pH略大 組卷:53引用:2難度:0.5 -
5.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.Na2S溶液:Hg2+、K+、 、Cl-NO-3B.鹽酸溶液:Na+、K+、 、SO2-4SiO2-3C.FeCl3溶液: 、Na+、NH+4、NO-3SO2-4D.NaHCO3溶液: 、Na+、NH+4、AlO-2SO2-4組卷:23引用:1難度:0.7 -
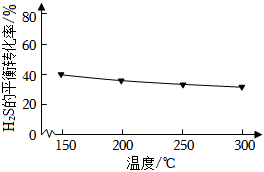 6.向恒容的密閉容器中充入amolCO和bmolH2S,發生反應:CO(g)+H2S(g)?COS(g)+H2(g),H2S的平衡轉化率如圖所示。下列說法正確的是( )
6.向恒容的密閉容器中充入amolCO和bmolH2S,發生反應:CO(g)+H2S(g)?COS(g)+H2(g),H2S的平衡轉化率如圖所示。下列說法正確的是( )A.150℃時,若該反應的平衡常數K= ,則a:b=6:513B.該反應為吸熱反應 C.若一段時間后, 保持不變,則該反應達到平衡狀態c(COS)c(H2)D.平衡后,向容器中再通入amolCO,v正逐漸增大 組卷:38引用:2難度:0.6
二、填空題(本題4個小題,共55分)。
-
18.丙烯腈(CH2=CHCN)是一種重要的化工原料,工業上可用“丙烯氨氧化法”生產,副產物有乙腈(CH3CN)、氫氰酸、丙烯醛(C3H4O)等,以丙烯、氨氣和氧氣為原料,在催化劑存在下合成丙烯腈的主要反應如下:
Ⅰ.C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g) ΔH1=-515kJ/mol32
Ⅱ.C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH2=-353kJ/mol
回答下列問題:
(1)C3H4O(g)+NH3(g)+O2(g)=C3H3N(g)+2H2O(g) ΔH=32kJ/mol。
(2)反應Ⅰ在(填“高溫”“低溫”或“任意”)條件下可自發進行;恒溫恒容條件下,若容器內只發生反應Ⅰ,下列選項表明反應一定已經達平衡狀態的是。
A.容器內混合氣體的密度不再變化
B.容器內混合氣體的平均摩爾質量不再變化
C.容器內壓強不再變化
D.v(NH3):v(O2)=2:3
(3)恒溫下,充入丙烯、氨氣和氧氣發生反應Ⅰ和Ⅱ,體系達到平衡后,若壓縮容器體積,則反應II的平衡移動方向為(填“正反應方向”“逆反應方向”或“不移動”)。
(4)已知對于反應:aA(g)+bB(g)?cC(g)+dD(g),其標準平衡常數:Kθ=。T℃,壓強為16pθ的恒壓密閉容器中,通入1mol丙烯、1mol氨氣和3mol氧氣發生反應Ⅰ、Ⅱ,達到平衡時,容器內有amolC3H3N(g),bmolC3H4O(g),此時H2O(g)的分壓p(H2O)=[p(C)pθ]c×[p(D)pθ]d[p(A)pθ]a×[p(B)pθ]b(分壓=總壓×物質的量分數,用含a,b的代數式表示,下同);反應Ⅱ的標準平衡常數為。
(5)以丙烯腈為原料,利用電解原理合成已二腈[CN(CH2)4CN]可減少氮氧化物的排放,其裝置如圖所示,電解時Pb電極發生的電極反應式為。 組卷:50引用:3難度:0.5
組卷:50引用:3難度:0.5 -
19.乙二酸(H2C2O4)俗稱草酸,是二元弱酸,在實驗研究和化學工業中應用廣泛。回答下列問題:
Ⅰ.查閱資料可知,常溫下,部分弱酸的電離平衡常數如下表:
(1)常溫下,pH=11的NaOH溶液與pH=3的氫氟酸溶液等體積混合,溶液顯弱酸 HF H2C2O4 電離平衡常數 Ka=6.3×10-4 Ka1=5.6×10-2
Ka2=1.5×10-4性(填“酸”“堿”或“中”)。
(2)向等體積、等pH的草酸和氫氟酸溶液中加入大小相同的鋅粒,初始速率分別是v1、v2,其大小關系為v1v2(填“>”“<”或“=”)。
(3)向Na2C2O4溶液中通入過量的HF,反應的化學方程式為。
Ⅱ.已知草酸晶體(H2C2O4?XH2O)可溶于水,并可與酸性高錳酸鉀溶液完全反應:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。現用氧化還原滴定法測定草酸晶體的結晶水分子數X,步驟如下:
①用分析天平稱取草酸晶體1.260g,將其配制成100.00mL待測草酸溶液
②用移液管移取25.00mL待測草酸溶液于錐形瓶中,并加入適量硫酸酸化
③用濃度為0.1000mol/L的KMnO4標準溶液進行滴定,三次結果如下:
已知:H2C2O4的相對分子質量為90。第一次滴定 第二次滴定 第三次滴定 待測溶液體積(mL) 25.00 25.00 25.00 標準溶液體積(mL) 9.99 10.01 10.00
(1)滴定時,KMnO4標準溶液應該裝在(填“酸式”或“堿式”)滴定管中。
(2)到達滴定終點的標志是。
(3)根據上述數據計算X=。
(4)誤差分析:若滴定開始時仰視滴定管刻度,滴定結束時俯視滴定管刻度,則X值(填“偏高”“偏低”或“無影響”)。組卷:108引用:1難度:0.5


