2022-2023學年黑龍江省哈爾濱三中高二(上)第二次月考化學試卷
發布:2024/10/28 17:30:3
一、選擇題(每小題有且只有一個選項符合題意,每小題3分,共60分)
-
1.下列敘述不正確的是( )
A.混亂度減小的吸熱反應一定不能自發進行 B.在溫度、壓強一定的條件下,自發反應總是向ΔG=ΔH-TΔS<0的方向進行 C.水結冰的過程不能自發進行的原因是熵減的過程,改變條件也不可能自發進行 D.碳酸氫鈉加熱可以分解,因為升高溫度利于熵增的方向自發進行 組卷:35引用:8難度:0.7 -
2.可逆反應M+N(s)?R達到平衡后,無論加壓或降溫,M的轉化率都增大,則下列結論正確的是氣體( )
A.M為固體,R為氣體,正反應為放熱反應 B.M為氣體,R為固體,正反應為放熱反應 C.M為氣體,R為固體,正反應為吸熱反應 D.M、R均為氣體,正反應為吸熱反應 組卷:26引用:2難度:0.5 -
3.下列過程中,化學反應速率減小對人類無益的是( )
A.金屬的腐蝕 B.食物的腐敗 C.塑料的老化 D.氨的合成 組卷:9引用:3難度:0.6 -
4.下表中物質的分類組合正確的是( )
選項 A B C D 強電解質 AlCl3 BaSO4 HClO KCl 弱電解質 NH3?H2O H2O CaCO3 Al(OH)3 非電解質 Cl2 CO2 NH3 HI A.A B.B C.C D.D 組卷:39引用:1難度:0.7 -
5.在密閉容器中進行如下反應:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始濃度分別為0.1mol/L、0.3mol/L、0.2mol/L,在一定條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.Y2為0.4mol/L B.Y2為0.3mol/L C.X2為0.2mol/L D.Z為0.4mol/L 組卷:46引用:3難度:0.8 -
6.下列說法正確的有( )
①不溶于水的鹽都是弱電解質
②可溶于水的鹽都是強電解質
③熔融的電解質不一定都能導電
④強酸溶液中的H+濃度不一定大于弱酸溶液中的H+濃度
⑤電解質溶液導電的原因是溶液中有自由移動的陰、陽離子
⑥0.5mol?L-1一元酸溶液中H+濃度一定為0.5mol?L-1A.1個 B.2個 C.3個 D.4個 組卷:42引用:1難度:0.8 -
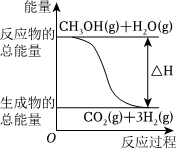 7.甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:
7.甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)ΔH=+49.0kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)ΔH=-192.9kJ/mol12
下列說法正確的是( )A.CH3OH的燃燒熱為192.9kJ/mol B.反應①中的能量變化如圖所示 C.CH3OH轉變成H2的過程一定要吸收能量 D.根據②推知CH3OH(l)+ O2(g)═CO2(g)+2H2(g)的ΔH>-192.9kJ/mol12組卷:49引用:4難度:0.8 -
8.已知:H2(g)+Br2(l)=2HBr(g)△H=-72kJ/mol。蒸發1mol Br2(l)需要吸收的能量為30kJ,其它相關數據如下表:則表中X為( )
HBr(g) H2(g) Br2(g) 1mol分子中的化學鍵斷裂時需要吸收的能量/kJ 369 436 X A.200 B.230 C.260 D.404 組卷:16引用:3難度:0.6
二、填空題(共40分)
-
23.德國人哈伯在1905年發明了合成氨的方法:N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1,他因此獲得了1918年諾貝爾化學獎。請回答下列問題:
(1)某化學研究性學習小組模擬工業合成氨的反應。在容積固定為2L的密閉容器內充入1molN2和3molH2,加入合適催化劑(體積可以忽略不計)后在一定溫度壓強下開始反應,并用壓力計監測容器內壓強的變化如下表:
則從反應開始到25min時,以H2表示的平均反應速率=反應時間/min 0 5 10 15 20 25 30 壓強/MPa 16.80 14.78 13.86 13.27 12.85 12.60 12.60 。
(2)隨著溫度升高,單位時間內NH3的產率增大,溫度高于900℃以后,單位時間內NH3的產率開始下降的原因可能是:①升高溫度催化劑活性降低;②。
(3)工業上利用氨氣生產氫氰酸(HCN)的反應為:NH3(g)+CH4(g)?3H2(g)+HCN(g)ΔH>0,在其他條件一定,該反應達到平衡時NH3轉化率隨外界條件Y變化的關系如圖所示,Y代表(填字母代號)。
A.原料中CH4與NH3的體積比
B.溫度
C.壓強
(4)500℃、壓強為10P0時,工業合成氨進料體積比V(N2):V(H2)=1:3時,平衡混合氣體中NH3的物質的量分數為20%,求Kp=[Kp為用平衡分壓代替平衡濃度計算求得的平衡常數(分壓=總壓×物質的量分數),用含P0的代數式表示]。
(5)我國科研人員發現在反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g)使用Pt單原子催化劑有著高達90%以上的甲醇選擇性。反應歷程如圖,其中TS表示過渡態,吸附在催化劑表面上的物種用*表示。
上述能壘為1.15eV的反應為。組卷:50引用:2難度:0.5 -
24.運用化學反應原理研究化學反應有重要意義。
Ⅰ.將氯化氫轉化為氯氣的反應為4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)。如圖為剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時HCl平衡轉化率隨溫度變化的關系,進料濃度比c(HCl):c(O2)等于1:1的曲線是。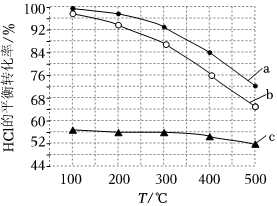
Ⅱ.(1)硫酸生產中,涉及反應2SO2(g)+O2(g)?2SO3(g)ΔH<0,不同壓強下反應體系中平衡時SO3的百分含量(α%)和溫度(T)的關系如圖所示。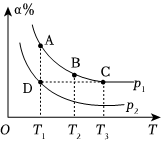
①p1p2(填“>”或“<”);C、D兩點的平衡常數:KCKD(填“>”“<”或“=”)。
②A、B、C、D四點反應速率由大到小的順序為(用A、B、C、D表示)。
③下列能使平衡向正反應方向移動,且能提高SO2的平衡轉化率的措施是(填標號)。
a.升高溫度
b.僅增大O2的濃度
c.僅增大SO2的濃度
(2)在三個容積相等的恒容密閉容器中按如表數據設定反應條件及投入反應物,發生反應2SO2(g)+O2(g)?2SO3(g)ΔH<0。
①c1、c2、c3由大到小的順序為容器1 容器2 容器3 反應溫度(T)K 700 700 800 反應物投入量 2molSO2、1molO2 4molSO3 2molSO2、1molO2 平衡時c(SO3)/mol?L-1 c1 c2 c3 平衡時體系總壓強(p)/Pa p1 p2 p3 物質的平衡轉化率(α) α1(SO2) α2(SO3) α3(SO2) 。
②2p1p2(填“>”“<”或“=”,下同);α1(SO2)+α2(SO3)1。組卷:34引用:1難度:0.5


