2023年江蘇省蘇州市吳中區、吳江區、相城區中考化學三模試卷
發布:2024/5/28 8:0:9
一、單項選擇題(包括20題,每題2分,共40分。每題只有一個選項最符合題意)
-
1.二十大報告指出,“要推進美麗中國建設,堅持山水林田湖草沙一體化保護和系統治理”。下列做法不符合這一要求的是( )
A.發展公共交通,提倡綠色出行 B.嚴禁亂砍濫伐,保護森林資源 C.深埋廢棄電池,避免影響農作物 D.禁止廢水任意排放,保護水資源 組卷:100引用:7難度:0.7 -
2.下列中國古代技術工藝的主要原理屬于化學變化的是( )
A.炭黑制墨 B.燒制陶瓷 C.針織絲綢 D.煮海取鹽 組卷:75引用:4難度:0.8 -
3.下列物質由離子構成的是( )
A.鎂 B.二氧化碳 C.金剛石 D.氯化鈉 組卷:49引用:9難度:0.6 -
4.下列有關物質的性質與用途具有對應關系的是( )
A.鹽酸易揮發,可用于除鐵銹 B.濃硫酸具有脫水性,可用作干燥劑 C.活性炭具有吸附性,可用于除冰箱異味 D.鋁有良好的導熱性,可用于制作電線 組卷:104引用:3難度:0.8 -
5.碳酸鈉在生產生活中有廣泛應用。下列有關碳酸鈉的認識不正確的是( )
A.化學式:Na2CO3 B.性質:碳酸鈉固體受熱易分解 C.用途:碳酸鈉溶液可與生石灰反應制燒堿 D.工業上用侯氏制堿法獲得碳酸鈉 組卷:70引用:3難度:0.6 -
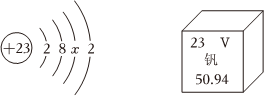 6.“釩”被譽為合金中的維生素,釩元素的原子結構示意圖及在元素周期表中的信息如圖,下列說法正確的是( )
6.“釩”被譽為合金中的維生素,釩元素的原子結構示意圖及在元素周期表中的信息如圖,下列說法正確的是( )A.x=8 B.V2+核外有23個電子 C.釩元素屬于金屬元素 D.釩原子的相對原子質量為50.94g 組卷:36引用:4難度:0.8 -
7.向溶液X中加入氫氧化鈉溶液,加熱,產生的氣體能使濕潤的紅色石蕊試紙變藍。則溶液X中一定含有的微粒是( )
A.Cl- B. CO2-3C.Ca2+ D. NH+4組卷:407引用:14難度:0.6 -
8.下列用氧化銅制取氫氧化銅的系列操作中正確的是( )
A. 
取用藥品B. 
添加藥品C. 
加快反應D. 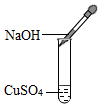
滴加堿液組卷:815引用:32難度:0.7
非選擇題(共60分)
-
25.某研究小組擬用廢舊鋅錳干電池炭包(主要成分為ZnCl2、NH4Cl、MnO2、炭粉,還含少量Cu、Ag、Fe)制備二氧化錳。
Ⅰ.制備MnCO3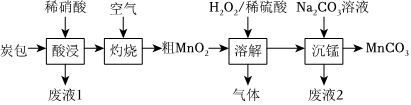
已知:①稀硝酸能與Cu、Ag、Fe反應,不與C、MnO2反應
②“溶解”反應的化學方程式為:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O
③Na2SO4+BaCl2=BaSO4↓+2NaCl
(1)炭包的主要成分中屬于鹽類的是(填寫化學式)。
(2)“酸浸”時需將結塊的炭包粉碎處理,目的是。
(3)“灼燒”的目的是。
(4)“溶解”過程中發現,H2O2的反應實際用量遠大于理論用量,原因是。
(5)“沉錳”發生反應的基本反應類型為。
(6)對所得MnCO3進行洗滌,證明已洗滌干凈的操作是:,則已洗凈。
Ⅱ.焙燒MnCO3制取MnO2
按如圖1所示裝置,取46.0gMnCO3于石英管中焙燒。由于MnCO3在空氣中加熱易轉化為不同價態的錳的氧化物,實驗過程中石英管內剩余固體的質量和成分隨溫度的變化如圖2所示。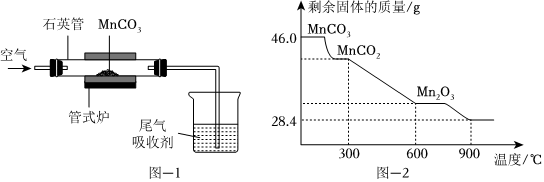
(7)焙燒MnCO3制取MnO2應控制反應溫度不高于℃。
(8)若焙燒溫度處于300~600℃范圍內,MnO2發生分解反應的化學方程式為。
(9)若焙燒溫度高于900℃時,所得固體成分的化學式為。組卷:131引用:2難度:0.3 -
26.硫酸亞鐵銨[化學式為(NH4)2SO4?FeSO4?6H2O,相對分子質量為392],可用作治療缺鐵性貧血的藥物。某學習小組利用鐵屑、稀硫酸和硫酸銨為原料,按如圖所示裝置制備少量硫酸亞鐵銨,并測定其純度。
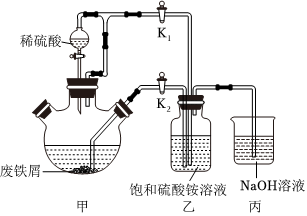
已知:a.一般的亞鐵鹽不穩定.硫酸亞鐵銨晶體較為穩定,在空氣中不易被氧化,易溶于水,不溶于乙醇,接近100℃時易失去結晶水。
b.硫化亞鐵能與硫酸反應,生成硫酸亞鐵和具有刺激性氣味的H2S。
c.制備摩爾鹽的化學方程式為(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4?FeSO4?6H2O。
實驗步驟:
①檢查裝置氣密性。
②往裝置甲中加入過量廢鐵屑(表面有油污,含硫化亞鐵雜質),其他藥品按要求加好。
③關閉止水夾K2、打開K1,打開分液漏斗旋塞并控制好滴速。
④把三頸燒瓶中液體轉移到裝置乙中,當出現大量淺綠色晶體時,關閉分液漏斗旋塞。
⑤將裝置乙中所得晶體過濾、洗滌和干燥,得到產品。
回答下列問題:
(1)實驗前,需將廢鐵屑放入碳酸鈉溶液中,煮沸清洗,目的是。
(2)為加快反應速率,可將裝置乙的溫度控制在80~95℃為宜,一般可采取的加熱方式是。
(3)步驟③的目的是。
(4)通過調節K1、K2的開閉,可實現步驟④將裝置甲中液體自動轉移至裝置乙中,具體的實驗操作為。
(5)步驟⑤中,過濾后的晶體用乙醇洗滌而不用蒸餾水洗滌的原因是。
(6)裝置丙中NaOH溶液的作用包括:①液封,防止空氣中氧氣進入裝置;②。
(7)測定產品的純度:稱取4.80g產品,溶于水配成溶液,滴加一定質量分數的重鉻酸鉀(化學式為K2Cr2O7,相對分子質量為294)溶液,恰好完全反應時,消耗重鉻酸鉀0.588g。反應化學方程式為K2Cr2O7+6[(NH4)2SO4?FeSO4?6H2O]+7H2SO4=K2SO4+3Fe2(SO4)3+Cr2(SO4)3+6(NH4)2SO4+43H2O。則所得產品的純度為。組卷:93引用:2難度:0.3


