2023年江蘇省南通市海安高級中學(xué)高考化學(xué)第五次段考試卷
發(fā)布:2024/4/23 12:26:7
一、單項(xiàng)選擇題:本題包括13小題,每小題3分,共計(jì)39分。每小題只有一個(gè)選項(xiàng)符合題意。
-
1.2023年4月20日,SpaceX的巨無霸航天器“星艦”在美國得克薩斯州的星基地進(jìn)行了試飛。下列關(guān)于“星艦”說法不正確的是( )
A.“星艦”采用不銹鋼外殼,不銹鋼密度比鋁合金大 B.“星艦”艦體外的燒蝕層可采用耐高溫材料 C.“星艦”及助推器都實(shí)現(xiàn)了重復(fù)使用,從而大大降低發(fā)射成本 D.“星艦”采用的猛禽發(fā)動機(jī)以液氧和甲烷為燃料,比使用NO2與偏二甲肼為燃料環(huán)保 組卷:40引用:2難度:0.5 -
 2.三氟化氯(ClF3)是極強(qiáng)助燃劑,能發(fā)生自耦電離:2ClF3?+ClF-4,其分子的空間構(gòu)型如圖,下列推測合理的是( )ClF+2
2.三氟化氯(ClF3)是極強(qiáng)助燃劑,能發(fā)生自耦電離:2ClF3?+ClF-4,其分子的空間構(gòu)型如圖,下列推測合理的是( )ClF+2A.ClF3分子的中心原子雜化軌道類型為sp2 B.ClF3中Cl元素化合價(jià)為+5 C.ClF3具有強(qiáng)還原性 D.BrF3比ClF3更易發(fā)生自耦電離 組卷:52引用:1難度:0.5 -
3.前3周期主族元素X、Y、Z、W的原子序數(shù)依次增大,X是空氣中含量最多的元素,基態(tài)時(shí)Y最外層電子數(shù)是次外層的四分之一,基態(tài)Z原子3p軌道上只有1個(gè)電子,W與X位于同一主族。下列說法正確的是( )
A.原子半徑:r(W)>r(Z)>r(Y)>r(X) B.第一電離能:I1(X)>I1(Y)>I1(Z) C.X的簡單氣態(tài)氫化物分子的空間構(gòu)型為平面三角形 D.最高價(jià)氧化物對應(yīng)水化物的堿性:Z>Y 組卷:42引用:4難度:0.6 -
4.以含鈷廢渣(主要成分CoO、Co2O3,還含有Al2O3、ZnO等雜質(zhì))為原料制備Co2O3的一種實(shí)驗(yàn)流程如圖:

下列與流程相關(guān)的裝置和原理能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵?br />
)
A.用裝置甲制備“酸浸”所需的SO2 B.用裝置乙配制“酸浸”所需的1mol?L-1H2SO4溶液 C.用裝置丙過濾“沉鈷”所得懸濁液 D.用裝置丁灼燒CoCO3固體制Co2O3 組卷:69引用:5難度:0.8 -
5.閱讀下列資料,完成5~7題:氧族元素用途廣泛。SO2既是大氣主要污染物之一,又在生產(chǎn)生活中具有廣泛應(yīng)用,如可生產(chǎn)SO3并進(jìn)而制得硫酸等,其反應(yīng)原理為:2SO2(g)+O2(g)═2SO3(g)ΔH=-196.6kJ?mol-1。TeO2微溶于水。
下列說法正確的是( )A.SO2與TeO2分子是含有極性鍵的極性分子 B.SO2與TeO2中鍵角都為120° C.碲原子(52Te)基態(tài)核外電子排布式為[Kr]5s25p4 D.ⅥA族元素單質(zhì)的晶體類型相同 組卷:16引用:0難度:0.50
二、非選擇題:共4題,共61分
-
16.硫氰化鉀(KSCN)俗稱玫瑰紅酸鉀,是一種用途廣泛的化學(xué)藥品。某實(shí)驗(yàn)小組模擬工業(yè)制備硫氰化鉀的并探究其性質(zhì)。
已知:NH4SCN分解溫度為140℃,KSCN分解溫度為500℃,NH4HS100℃以上可完全分解。
Ⅰ.制備KSCN樣品,實(shí)驗(yàn)裝置如圖:
(1)實(shí)驗(yàn)開始時(shí)關(guān)閉K2,水浴加熱,打開K1,緩緩地向三頸燒瓶中持續(xù)通入NH3和N2,發(fā)生反應(yīng)CS2+3NH3NH4SCN+NH4HS。導(dǎo)氣管末端伸入CS2層的目的是使反應(yīng)更充分且催化劑水浴加熱。
(2)一段時(shí)間后,當(dāng)觀察到三頸燒瓶內(nèi)時(shí),停止通入氣體,反應(yīng)完成。
(3)補(bǔ)充完整實(shí)驗(yàn)操作:關(guān)閉K1,,將三頸燒瓶中液體過濾,,洗滌干燥得到KSCN晶體。(實(shí)驗(yàn)中須使用的試劑:5mol/LKOH溶液,CuSO4溶液)
Ⅱ.KSCN含量的測定
稱取10.00g上述樣品,配成1000mL溶液。準(zhǔn)確量取20.00mL溶液于錐形瓶中,加入適量稀硝酸,再加入幾滴Fe(NO3)3溶液作指示劑,用0.1000mol?L-1AgNO3標(biāo)準(zhǔn)溶液滴定,達(dá)到滴定終點(diǎn)時(shí)消耗AgNO3標(biāo)準(zhǔn)溶液18.00mL。[滴定時(shí)發(fā)生的反應(yīng)為SCN-+Ag+═AgSCN↓(白色)]。
(4)計(jì)算樣品中KSCN的質(zhì)量分?jǐn)?shù)為。(寫出計(jì)算過程)
Ⅲ.性質(zhì)應(yīng)用
在試管中依次加入1滴0.2mol?L-1(NH4)2Fe(SO4)2溶液、5mL飽和碘水、1滴0.1mol?L-1AgNO3溶液,tmin后加入1滴KSCN溶液,溶液變紅。甲同學(xué)認(rèn)為是I2氧化了Fe2+,乙同學(xué)提出了質(zhì)疑,認(rèn)為實(shí)驗(yàn)現(xiàn)象不能證明I2氧化了Fe2+,可能是AgNO3氧化了Fe2+。
(5)請?jiān)O(shè)計(jì)實(shí)驗(yàn)方案驗(yàn)證乙同學(xué)的質(zhì)疑。組卷:75引用:1難度:0.4 -
17.甲醇作為新型清潔可再生燃料,對緩解能源危機(jī)以及實(shí)現(xiàn)“碳中和”目標(biāo)具有重要的戰(zhàn)略意義。
Ⅰ.二氧化碳在某種催化劑條件下加氫制甲醇反應(yīng)過程如下:
①CO2(g)+H2(g)═CO(g)+H2O(g)ΔHl=+41kJ?mol-1
②CO(g)+2H2(g)═CH3OH(g)ΔH2=-90kJ?mol-1
(1)二氧化碳加氫制甲醇的總反應(yīng)熱化學(xué)方程式:。
(2)該催化條件下,實(shí)際工業(yè)生產(chǎn)中,需要在260℃、壓強(qiáng)恒為4.0MPa的反應(yīng)釜中進(jìn)行上述反應(yīng)。初始時(shí)向反應(yīng)釜中加入0.01mol CO2(g)和0.03moH2(g),為確保反應(yīng)的連續(xù)性,需向反應(yīng)釜中以進(jìn)氣流量0.04mol/min、n(CO2):n(H2)=1:3持續(xù)通入原料,同時(shí)控制出氣流量。
①需控制出氣流量小于進(jìn)氣流量的原因?yàn)?。
②已知出氣流量為0.03mol/min,單位時(shí)間CO2(g)的轉(zhuǎn)化率為60%,則流出氣體中CO(g)的百分含量為。
(3)另一種CO2催化加氫合成CH3OH機(jī)理如圖1所示(吸附在催化劑表面的物種用*標(biāo)注)。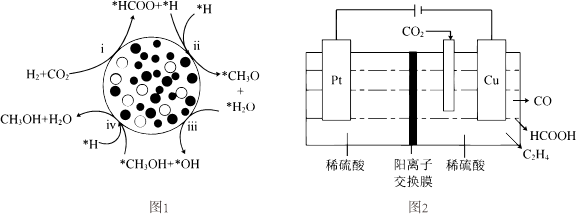
從化學(xué)鍵視角,圖中ⅰ與ⅱ的過程可描述為。
Ⅲ.用電解法可將CO2轉(zhuǎn)化為多種燃料,原理如圖2所示。
(4)若陰極只生成CO、HCOOH、C2H4,且各產(chǎn)物生成速率相同,則相同條件下,Pt電極產(chǎn)生的O2與Cu電極上產(chǎn)生的C2H4的體積比為。
(5)甲醇作為一種高能量密度的能源載體,具有廣闊的發(fā)展前景。
已知:燃料的能量密度是單位體積的燃料包含的能量,單位kJ/m3。熱值是單位質(zhì)量的燃料完全燃燒時(shí)所放出的熱量,單位kJ/g。
在一定溫度和催化劑作用下,車載甲醇可直接轉(zhuǎn)變?yōu)闅錃猓瑥亩鵀闅溲跞剂想姵靥峁湓础R阎獨(dú)錃夂图状嫉臒嶂捣謩e為143kJ/g和23kJ/g,與車載氫氣供能模式相比,車載甲醇供能模式的優(yōu)點(diǎn)是。組卷:54引用:1難度:0.5


