2022年湖南省婁底五中高考化學模擬試卷(5月份)
發布:2024/4/20 14:35:0
一、單項選擇題:本題共10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項符合題目要求。
-
1.《天工開物——作咸篇》有如下記載:“潮波淺被地,不用灰壓。候潮一過,明日天晴,半日曬出鹽霜,疾趨掃起煎煉。”下列說法正確的是( )
A.“煎煉”所得物質俗稱“火堿” B.“作咸”過程涉及“蒸餾”操作 C.“作咸”在實驗室完成會用到蒸發皿、酒精燈 D.該記載過程中涉及氧化還原反應和復分解反應 組卷:27引用:7難度:0.7 -
2.美好生活離不開化學,下列人類活動運用相應的化學原理正確的是( )
A.NH4+水解使氯化銨溶液顯酸性,NH4Cl溶液能除鐵銹 B.游輪底部定期更換鋅塊是利用電解原理防止游輪底部腐蝕 C.鋁是金屬晶體,具有良好的延展性,易于加工,所以常用鋁罐等貯運濃硝酸 D.纖維素最終的水解產物是葡萄糖,所以人類要食用一定量纖維素 組卷:33引用:2難度:0.5 -
3.NA表示阿伏加德羅常數的值,下列說法中正確的是( )
A.0.1mol NaHSO4固體所含的離子總數為0.3NA B.12g石墨所含的C-C鍵的數目約為2.408×1024 C.標準狀況下將22.4L NH3溶于水配成1mol/L的溶液,則c(NH4+)+c(NH3?H2O)=1mol/L D.常溫下,1L pH=5的CuCl2溶液中由水電離出的H+數為10-5NA 組卷:62引用:5難度:0.6 -
4.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A. =10-12的溶液中NH4+、Ba2+、Cl-、NO3-c(H+)c(OH-)B.能使甲基橙變紅的溶液中:Fe2+、K+、NO3-、SO42- C.透明的溶液中:K+、Na+、SO42-、MnO4- D.由水電離的 c(OH-)=1×10-10 mol?L-1 的溶液中:K+、Na+、NO3-、Al3+ 組卷:29引用:2難度:0.7 -
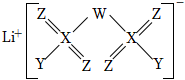 5.2019年諾貝爾化學獎頒給研究鋰電池的科學家,一種用作鋰電池電解液的鋰鹽結構如圖所示。其中,X位于第三周期,X原子的電子數為Z原子的兩倍,W、Z、Y位于同一周期。下列敘述正確的是( )
5.2019年諾貝爾化學獎頒給研究鋰電池的科學家,一種用作鋰電池電解液的鋰鹽結構如圖所示。其中,X位于第三周期,X原子的電子數為Z原子的兩倍,W、Z、Y位于同一周期。下列敘述正確的是( )A.原子半徑:X>Z>W B.非金屬性:X>Z>W C.X的氧化物對應的水化物均為強酸 D.WY3中各原子均滿足8電子穩定結構 組卷:53引用:5難度:0.5 -
6.短周期元素X、Y、Z、W的原子序數依次增大,X是空氣中含量最多的元素,基態時Y原子2p原子軌道上有5個電子,Z的周期序數是族序數的3倍,W與Y屬于同一主族。下列說法正確的是( )
A.原子半徑:r(X)<r(Y)<r(Z)<r(W) B.X的第一電離能比同周期相鄰元素的大 C.Y的簡單氣態氫化物的熱穩定性比W的弱 D.Z的最高價氧化物對應水化物的酸性比W的強 組卷:38引用:3難度:0.5
三、非選擇題:本題共4小題,共50分
-
18.2022年1月24日,習近平總書記在十九屆中共中央政治局第三十六次集中學習時強調,實現碳達峰碳中和是貫徹新發展理念、構建新發展格局、推動高質量發展的內在要求。因此,二氧化碳的合理利用成為研究熱點。
(1)以CO2和NH3為原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反應可表示如下:
反應I:2NH3(g)+CO2(g)═NH2COONH4(s)ΔH1=-159.5kJ/mol
反應II:NH2COONH4(s)═CO(NH2)2(s)+H2O(g)ΔH2=+72.5kJ/mol
總反應III:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)ΔH3
反應III的ΔH3=kJ/mol,據此判斷該反應在_(填“低溫”、“高溫”或“任意溫度”)條件下能自發進行。
(2)二甲醚(CH3OCH3)被譽為“21世紀的清潔燃料,以CO2、H2為原料制備二甲醚涉及的主要反應如下:
I.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)ΔH1=-122.5kJ/mol
II.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41.1kJ/mol
①在壓強、CO2和H2的起始投料一定的條件下,發生反應I、II,實驗測得CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖1所示。(已知:CH3OCH3的選擇性=100%)2×CH3OCH3的物質的量反應的CO2的物質的量×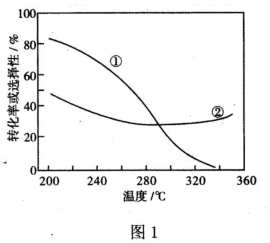
其中表示平衡時CH3OCH3的選擇性的曲線是(填“①”或“②”);溫度高于300℃時,曲線②隨溫度升高而升高的原因是;為同時提高CO2的平衡轉化率和平衡時CH3OCH3的選擇性,應選擇的反應條件為(填標號)。
a.高溫、高壓
b.低溫、高壓
c.高溫、低壓
d.低溫、低壓
②對于反應II的反應速率v=v正-v逆=k正p(CO2)?p(H2)-k逆p(CO)?p(H2O),其中k正、k逆分別為正、逆反應速率常數,p為氣體的分壓(分壓=總壓×物質的量分數)。
a.降低溫度,k正-k逆(填“增大”、“減小”或”不變”);
b.在一定溫度和壓強下的反應II,按照n(H2):n(CO2)=1:1投料,CO2轉化率為50%時,v(正):v(逆)=3:4,用氣體分壓表示的平衡常數Kp=。
(3)用H2還原CO2可以合成CH3OH:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。恒壓下,CO2和H2的起始物質的量之比為1:3時,該反應在無分子篩膜時甲醇的平衡產率和有分子篩膜(能選擇性分離出H2O)時甲醇的產率隨溫度的變化如圖2所示。P點甲醇產率高于T點的原因為。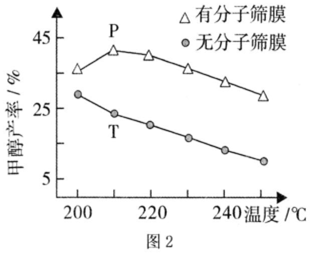
(4)CO2的再利用技術是促進可持續發展的措施之一,南開大學化學學院陳軍院士課題組則成功研制出新型的Na-CO2電池,如圖3是一種Na-CO2二次電池,其中鈉和負載碳納米管的鎳網分別作為電極材料,電池放電產物為Na2CO3和C,則放電時正極電極反應式為。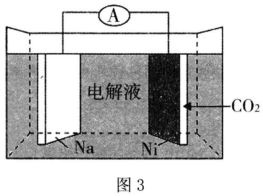 組卷:36引用:2難度:0.6
組卷:36引用:2難度:0.6 -
19.天然產物全合成是現代有機化學的重要研究方向,H是合成某種生物酶的核心中間體,其結構簡式為
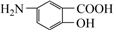 ,合成路線如圖。
,合成路線如圖。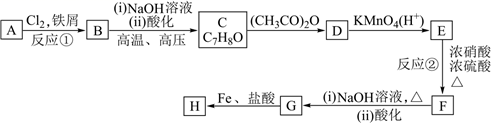
已知:Ⅰ: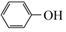 (CH3CO)2O
(CH3CO)2O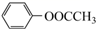
Ⅱ:R-COOHR-CH2OH(還原性:LiAlH4>Fe/HCl)LiAlH4
(1)B的名稱為;C→D的反應類型是。
(2)F的分子式為;鑒別F和G可選用的試劑為。
(3)寫出F→G第一步的化學方程式。
(4)設計C→D、F→G的目的是。
(5)I是D的一種同系物,其相對質量比D大28,則滿足下列條件的I的同分異構體共有種。
A.能與NaHCO3溶液反應放出氣體
B.核磁共振氫譜圖中顯示共有5組峰
寫出其中核磁共振氫譜圖中峰面積之比為1:4:6:2:1的同分異構體的結構簡式。(任寫一種)
(6)已知:苯環上連有羧基時取代通常發生在間位,據此寫出以烴A和草酸為原料合成高分子化合物(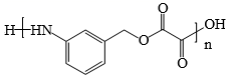 )的合成路線(無機試劑任選):。組卷:70引用:4難度:0.5
)的合成路線(無機試劑任選):。組卷:70引用:4難度:0.5


