2020-2021學(xué)年陜西省西安市高新一中高一(下)月考化學(xué)試卷(5月份)
發(fā)布:2024/10/31 15:30:2
一、選擇題(本題包括10小題,每題2分,共20分,每題只有一個(gè)正確答案)
-
1.2010年諾貝爾化學(xué)獎(jiǎng)授予理查德?海克等三位科學(xué)家,以表彰他們?cè)凇扳Z催化交叉偶聯(lián)”方面的研究.下面關(guān)于催化劑的說法正確的是( )
A.催化劑只改變反應(yīng)的正反應(yīng)速率 B.催化劑通過升高反應(yīng)的活化能來加快反應(yīng)速率 C.催化劑能夠改變反應(yīng)的反應(yīng)熱 D.催化劑不能改變反應(yīng)物的轉(zhuǎn)化率 組卷:88引用:21難度:0.9 -
2.在恒溫恒壓、不做功時(shí),反應(yīng)A+B═C+D在下列哪種情況下,一定能自發(fā)進(jìn)行( )
A.△H<0,△S<0 B.△H>0,△S<0 C.△H<0,△S>0 D.△H>0,△S>0 組卷:584引用:24難度:0.9 -
3.下列關(guān)于化學(xué)平衡狀態(tài)的說法中正確的是( )
A.改變外界條件不能改變化學(xué)平衡狀態(tài) B.當(dāng)某反應(yīng)在一定條件下反應(yīng)物轉(zhuǎn)化率保持不變時(shí)即達(dá)到了化學(xué)平衡狀態(tài) C.當(dāng)某反應(yīng)體系中氣體的壓強(qiáng)不再改變時(shí),該反應(yīng)一定達(dá)到平衡狀態(tài) D.當(dāng)某反應(yīng)達(dá)到平衡狀態(tài)時(shí),反應(yīng)物和生成物的濃度一定相等 組卷:60引用:8難度:0.7 -
4.在2A(g)+B(s)?3C(g)+5D(g)反應(yīng)中,表示該反應(yīng)速率最快的是( )
A.υ(A)=0.5mol/(L?s) B.υ(B)=0.3mol/(L?s) C.υ(C)=0.8mol/(L?s) D.υ(D)=1mol/(L?s) 組卷:87引用:6難度:0.8 -
5.下列敘述中,不能用平衡移動(dòng)原理解釋的是( )
A.紅棕色的NO2,加壓后顏色先變深后變淺 B.高壓比常壓有利于合成SO3的反應(yīng) C.由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深 D.黃綠色的氯水光照后顏色變淺 組卷:235引用:58難度:0.7 -
6.關(guān)于強(qiáng)弱電解質(zhì)及非電解質(zhì)的組合完全正確的是( )
A B C D 強(qiáng)電解質(zhì) NaCl H2SO4 NaOH HNO3 弱電解質(zhì) HF BaSO4 CaCO3 CH3COOH 非電解質(zhì) Cl2 CO2 C2H5OH SO2 A.A B.B C.C D.D 組卷:171引用:5難度:0.9 -
7.下列與化學(xué)反應(yīng)能量變化相關(guān)的敘述正確的是( )
A.生成物總能量一定低于反應(yīng)物總能量 B.等量H2在O2中完全燃燒,生成H2O(g)與生成H2O(l)放出的能量相同 C.應(yīng)用蓋斯定律,可計(jì)算某些難以直接測(cè)量的反應(yīng)焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點(diǎn)燃條件下的△H不同 組卷:18引用:5難度:0.9 -
8.下列關(guān)于反應(yīng)能量的說法正確的是( )
A.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ?mol-1,則反應(yīng)物總能量大于生成物總能量 B.若一定條件下,A═B△H<0,說明A物質(zhì)比B物質(zhì)穩(wěn)定 C.101 kPa時(shí),2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1,則H2的燃燒熱為571.6 kJ?mol-1 D.H+ (aq)+OH- (aq)═H2O(l)△H=-57.3 kJ?mol-1,含1 mol NaOH的溶液與含0.5 mol H2SO4的濃硫酸混合后放出57.3 kJ的熱量 組卷:24引用:4難度:0.9
三.填空題(本題包括4小題,共50分)
-
24.汽車尾氣里含有的NO氣體是由于內(nèi)燃機(jī)燃燒的高溫引起氮?dú)夂脱鯕夥磻?yīng)所致:
N2(g)+O2(g)?2NO(g)△H>0,已知該反應(yīng)在240℃,平衡常數(shù)K=64×10-4.請(qǐng)回答:
(1)某溫度下,向2L的密閉容器中充入N2和O2各1mol,5分鐘后O2的物質(zhì)的量為0.5mol,則N2的反應(yīng)速率為.
(2)假定該反應(yīng)是在恒容條件下進(jìn)行,判斷該反應(yīng)達(dá)到平衡的標(biāo)志.
A.消耗1mol N2同時(shí)生成1mol O2
B.混合氣體密度不變
C.混合氣體平均相對(duì)分子質(zhì)量不變
D.2v正(N2)=v逆(NO)
(3)將N2、O2的混合氣體充入恒溫恒容密閉容器中,如圖變化趨勢(shì)正確的是(填字母序號(hào)).
(4)向恒溫恒容的密閉容器中充入等物質(zhì)的量的N2和O2,達(dá)到平衡狀態(tài)后再向其中充入一定量NO,重新達(dá)到化學(xué)平衡狀態(tài).與原平衡狀態(tài)相比,此時(shí)平衡混合氣中NO的體積分?jǐn)?shù).(填“變大”、“變小”或“不變”)
(5)該溫度下,某時(shí)刻測(cè)得容器內(nèi)N2、O2、NO的濃度分別為2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此時(shí)反應(yīng)(填“處于化學(xué)平衡狀態(tài)”、“向正反應(yīng)方向進(jìn)行”或“向逆反應(yīng)方向進(jìn)行”),理由是.組卷:582引用:15難度:0.5 -
 25.25℃時(shí),部分物質(zhì)的電離平衡常數(shù)如表所示:
25.25℃時(shí),部分物質(zhì)的電離平衡常數(shù)如表所示:
請(qǐng)回答下列問題:化學(xué)式 CH3COOH H2CO3 HClO HCN
電離平衡常數(shù)(Ka)
1.8×10-5Ka1=4.3×10-7
Ka2=5.6×10-11
3.0×10-8
5.0×10-10
(1)CH3COOH、H2CO3、HClO、HCN 的酸性由強(qiáng)到弱的順序?yàn)?。
(2)寫出 H2CO3 溶液中含 C 元素的微粒有:。
(3)向 NaCN 中通入少量的 CO2,發(fā)生的離子方程式為。
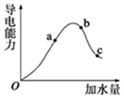
(4)取 0.10mol CH3COOH (冰醋酸)作導(dǎo)電性實(shí)驗(yàn),測(cè)得其平衡時(shí)的導(dǎo)電率隨加入的水量 變化如圖所示:比較 a、b、c 點(diǎn)的相關(guān)性質(zhì)(填“>”“<”或“=”):
①常溫下,b 點(diǎn)醋酸溶液的濃度約為 0.02mol?L-1;該溶液中的 CH3COOH 的電離度為,若使此溶液中 CH3COOH 的電離程度增大且 c(H+)也增大的方法是。
②從圖象可知,在一定濃度的醋酸溶液中加水 c(CH3COO-)(填增大,減小,或不確定)
③若實(shí)驗(yàn)測(cè)得 c 點(diǎn)處溶液中 c(CH3COOH)=amol?L-1,c(CH3COO-)=b mol?L-1,則該條件下 CH3COOH 的電離常數(shù) Ka=。(用含 a、b 的代數(shù)式表示)
④H+濃度相同等體積的兩份溶液 A(鹽酸)和 B(CH3COOH)分別與不同質(zhì)量的鋅粉反應(yīng),若最后僅有一份溶液中存在鋅,放出氫氣的質(zhì)量相同,則下列說法正確的是(填寫序號(hào))
a.反應(yīng)所需要的時(shí)間 B>A
b.開始反應(yīng)時(shí)的速率 A>B
c.參加反應(yīng)的鋅物質(zhì)的量 A=B
d.A 中有鋅剩余組卷:25引用:2難度:0.7


