2021-2022學年天津實驗中學濱海學校黃南民族班高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題4分,共64分)
-
1.某化學興趣小組用鋁片與稀硫酸反應制取氫氣,以下能夠加快該反應速率的是( )
①用98%的濃硫酸代替稀硫酸 ②加熱 ③改用鋁粉 ④增大稀硫酸的體積 ⑤加水 ⑥加入少量硫酸銅.A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥ 組卷:79引用:10難度:0.9 -
2.下列說法正確的是( )
A.增大壓強,活化分子數增多,化學反應速率一定增大 B.升高溫度,活化分子百分數不一定增大,化學反應速率一定增大 C.加入反應物,使活化分子百分數增加,化學反應速率增大 D.使用催化劑,降低了反應的活化能,增大了活化分子百分數,化學反應速率一定增大 組卷:371引用:15難度:0.9 -
3.已知合成氨反應:N2(g)+3H2(g)?2NH3(g),其濃度數據如下:
當用氫氣濃度的減少來表示該化學反應的速率時,其速率為( )N2 H2 NH3 起始濃度/mol?L-1 1.0 3.0 0 2s末濃度/mol?L-1 0.6 1.8 0.8 A.0.4mol?L-1?s-1 B.0.6mol?L-1?s-1 C.0.9mol?L-1?s-1 D.1.2mol?L-1?s-1 組卷:86引用:1難度:0.8 -
4.已知反應 2NH3=N2+3H2,在某溫度下的平衡常數為0.25,在此條件下,氨的合成反應N2+3H2=2NH3的平衡常數為( )
A.4 B.2 C.1 D.0.5 組卷:122引用:7難度:0.8 -
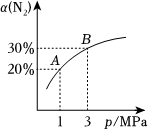 5.某溫度下,對于反應N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.N2的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。下列說法正確的是( )
5.某溫度下,對于反應N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.N2的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。下列說法正確的是( )A.將1mol氮氣、3mol氫氣,置于1L密閉容器中反應,待平衡后放出的熱量為92.4kJ B.平衡狀態由A變為B時,平衡常數K(A)<K(B) C.上述反應在達到平衡后,增大壓強,H2的轉化率增大 D.升高溫度,平衡常數K增大 組卷:24引用:9難度:0.5 -
6.一定溫度下的恒容密閉容器中,下列哪些物理量不再發生變化時,表明反應A(g)+2B(g)?C(g)+D(g)已達到化學平衡狀態的是( )
①混合氣體的壓強
②混合氣體的密度
③B的物質的量濃度
④混合氣體的總物質的量
⑤混合氣體的平均相對分子質量
⑥混合氣體的總質量
⑦混合氣體的總體積A.①②③④⑤⑥⑦ B.①③④⑤ C.①②③④⑤⑦ D.②⑥⑦ 組卷:112引用:4難度:0.5
二、非選擇題
-
18.現有S2-、
、SO2-3、Al3+、Na+、NH+4、Fe3+、SO2-4、Cl-等離子,請按要求填空:HCO-3
(1)在水溶液中,該離子水解呈堿性的是.
(2)在水溶液中,該離子水解呈酸性的是.
(3)既能在酸性較強的溶液里大量存在,又能在堿性較強的溶液里大量存在的離子有.
(4)既不能在酸性較強的溶液里大量存在,又不能在堿性較強的溶液里大量存在的離子有.組卷:176引用:5難度:0.5 -
19.(1)25℃時,濃度為0.1mol?L-1的6種溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2CO3,⑤KCl,
⑥NH4Cl溶液pH由小到大的順序為(填寫編號).
(2)25℃時,醋酸的電離常數Ka=1.7×10-5mol/L,則該溫度下CH3COONa的水解平衡常數Kh=mol?L-1(保留到小數點后一位).
(3)25℃時,pH=3的醋酸和pH=11的氫氧化鈉溶液等體積混合后,溶液呈(填“酸性”,“中性”或“堿性”),請寫出溶液中離子濃度間的一個等式:.
(4)25℃時,將m mol/L的醋酸和n mol/L的氫氧化鈉溶液等體積混合后,溶液的pH=7,則溶液中
c(CH3COO-)+c(CH3COOH)=,m與n的大小關系是mn(填“>”“=”或“<”).
(5)25℃時,將等體積、等物質的量濃度的醋酸與氨水混合后,溶液的pH=7,則NH3?H2O的電離常數Ka=.組卷:87引用:6難度:0.5


