2022-2023學年北京三十五中高二(上)月考化學試卷(10月份)
發(fā)布:2024/11/23 2:30:1
一、選擇題(共20個小題,1-10題每題2分,11-20題每題3分,共50分。每小題只有一個正確選項,請將正確答案填在機讀卡相應的題號處)
-
1.高粱釀酒過程中的部分流程按順序排列如下,其中能說明高粱轉(zhuǎn)化過程中放出熱量的是( )
A B C D 



“蒸糧”時加熱 “拌曲”前攤晾 “堆酵”時升溫 “餾酒”時控溫 A.A B.B C.C D.D 組卷:142引用:10難度:0.7 -
2.下列變化中,屬于吸熱反應的是( )
A.鋁粉與氧化鐵粉末反應 B.酸堿中和反應 C.碳酸鈣受熱分解 D.乙醇燃燒 組卷:81引用:4難度:0.7 -
3.下列有關(guān)自發(fā)反應的說法中,正確的是( )
A.自發(fā)反應都是放熱反應 B.自發(fā)反應都是熵增大的反應 C.自發(fā)反應一定能發(fā)生 D.非自發(fā)反應在一定條件下能發(fā)生 組卷:23引用:4難度:0.9 -
4.下列說法中正確的是( )
A.需要加熱才能發(fā)生的反應一定是吸熱反應 B.任何放熱反應在常溫條件下一定能夠發(fā)生 C.反應物總能量大于生成物總能量的反應是吸熱反應 D.反應物和生成物所具有的總能量的差決定了化學反應是放熱還是吸熱反應 組卷:25引用:2難度:0.7 -
5.25℃101kPa時,反應S(s)+O2(g)═SO2(g) ΔH=-297.23kJ/mol。下列說法中正確的是( )
A.S(g)+O2(g)═SO2(g) 放出的熱量大于297.23kJ B.S的燃燒熱為297.23kJ C.相同條件下,S具有的能量高于SO2具有的能量 D.形成1molSO2的化學鍵釋放的總能量小于斷裂1molS(g) 和1molO2(g) 的化學鍵所吸收的總能量 組卷:21引用:1難度:0.7 -
6.可逆反應A(g)+B(g)?C(g)+D(g)。在一定條件下,說明該反應已達到平衡狀態(tài)的是( )
A.容器內(nèi)壓強不隨時間變化 B.D、C的生成速率相等 C.A、B、C、D四者共存 D.A、D的消耗速率相等 組卷:25引用:1難度:0.5 -
7.聯(lián)氨(N2H4)是一種應用廣泛的化工原料,可用作火箭燃料.已知:
①N2H4(l)+N2O4(l)═12N2(g)+2H2O(l)△H=-546.45kJ/mol32
②H2O(g)═H2O(l)△H=-44.0kJ/mol
則2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )A.-916.9 kJ/mol B.-458.45 kJ/mol C.+916.9 kJ/mol D.+458.45 kJ/mol 組卷:246引用:5難度:0.7 -
8.已知反應A(g)+3B(g)?2C(g)+2D(g),四種情況下測得反應速率,其中能表明該反應進行最快的是( )
A.v(D)=0.4mol?L-1?s-1 B.v (C)=0.5mol?L-1?s-1 C.v (B)=0.6mol?L-1?s-1 D.v (A)=0.15mol?L-1?s-1 組卷:31引用:2難度:0.5
二、填空題:請將答案填寫在答題紙的相應題號處。
-
24.甲醇是重要的化工原料,發(fā)展前景廣闊。
Ⅰ.溫度為T1時,向容積為2L的密閉容器甲、乙中分別充入一定量的CO和H2O(g),發(fā)生反應:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH=-41kJ/mol。相關(guān)數(shù)據(jù)如下:
(1)甲容器中,反應在t1min內(nèi)的平均速率v(H2)=容器 甲 乙 反應物 CO H2O CO H2O 起始時物質(zhì)的量(mol) 1.2 0.6 2.4 1.2 平衡時物質(zhì)的量(mol) 0.8 0.2 a b 達到平衡的時間(min) t1 t2 mol/(L?min)。
(2)甲容器中,平衡時,反應放出的熱量kJ。
(3)T1時,反應的平衡常數(shù)K甲=。
(4)乙容器中,a=mol。
(5)解釋升高溫度使CO2平衡濃度降低的原因:。
Ⅱ.研究表明CO2加氫可以合成甲醇。CO2和H2可發(fā)生如下兩個反應:
反應Ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1
反應Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2
(6)反應Ⅰ的化學平衡常數(shù)表達式K=。
(7)有利于提高反應Ⅰ中CO2的平衡轉(zhuǎn)化率的措施有(填序號)。
a.使用催化劑
b.加壓
c.增大CO2和H2的初始投料比
(8)研究溫度對于甲醇產(chǎn)率的影響。在210℃~290℃,保持原料氣中CO2和H2的投料比不變,按一定流速通過催化劑甲,主要發(fā)生反應Ⅰ,得到甲醇的實際產(chǎn)率、平衡產(chǎn)率與溫度的關(guān)系如圖所示。
ΔH10(填“>”、“=”或“<”),其依據(jù)是。
(9)某實驗控制壓強一定,CO2和H2初始投料比一定,按一定流速通過催化劑乙,經(jīng)過相同時間測得如下實驗數(shù)據(jù)(反應未達到平衡狀態(tài)):
[注]甲醇選擇性:轉(zhuǎn)化的CO2中生成甲醇的百分比。表中實驗數(shù)據(jù)表明,升高溫度,CO2的實際轉(zhuǎn)化率提高而甲醇的選擇性降低,其原因是T(K) CO2實際轉(zhuǎn)化率(%) 甲醇選擇性(%)【注】 543 12.3 42.3 553 15.3 39.1 。組卷:28引用:1難度:0.3 -
25.某小組研究了銅片與5.6mol?L-1HNO3反應的速率,實驗現(xiàn)象記錄如表。
為了探究影響該反應速率的主要因素,小組進行如下實驗。實驗 時間段 現(xiàn)象 
0~15min 銅片表面出現(xiàn)極少氣泡 15~25min 銅片表面產(chǎn)生較多氣泡,溶液呈很淺的藍色 25~30min 銅片表面均勻冒出大量氣泡 30~50min 銅片表面產(chǎn)生較少氣泡,溶液藍色明顯變深,液面上方呈淺棕色
實驗Ⅰ:監(jiān)測上述反應過程中溶液溫度的變化,所得曲線如圖1.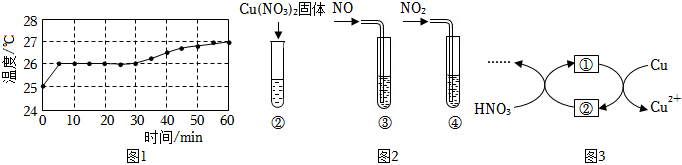
實驗Ⅱ:②~④試管中加入大小、形狀相同的銅片和相同體積、5.6mol?L-1HNO3.結(jié)果顯示:Cu(NO3)2、NO對Cu和HNO3反應速率的影響均不明顯,NO2能明顯加快該反應的速率。
實驗Ⅲ:在試管中加入銅片和5.6mol?L-1 HNO3,當產(chǎn)生氣泡較快時,取少量反應液于試管中,檢驗后發(fā)現(xiàn)其中含有NO2-。
(1)根據(jù)表格中的現(xiàn)象,描述該反應的速率隨時間的變化情況:。
(2)實驗Ⅰ的結(jié)論:溫度升高(填“是”或“不是”)反應速率加快的主要原因。
(3)實驗Ⅱ的目的是:。
(4)小組同學查閱資料后推測:該反應由于生成某中間產(chǎn)物而加快了反應速率,請結(jié)合實驗Ⅱ、Ⅲ,在圖3方框內(nèi)填入相應的微粒符號,以補全催化機理。
(5)為驗證(4)中猜想,還需補充一個實驗:(請寫出操作和現(xiàn)象)。組卷:38引用:7難度:0.5


