2019-2020學年四川省遂寧中學高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個答案正確,每小題3分,共48分)
-
1.下列描述中正確的是( )
A.CS2為V形的極性分子 B.ClO3-的空間構型為平面三角形 C.SiF4和SO32-的中心原子均為sp3雜化 D.SF6中有4對完全相同的成鍵電子對 組卷:1引用:1難度:0.7 -
2.下列有關數據的比較中,不正確的是( )
A.NaOH晶體中的陽離子和陰離子數目相等 B.元素的價電子數和所在族的族序數相等 C.[Co(NH3)6]3+中的NH3分子數與配位鍵數相等 D.CsCl晶體中每個Cs+周圍緊鄰的Cl-和每個Cl-周圍緊鄰的Cs+個數相等 組卷:1引用:1難度:0.8 -
3.下列有關說法正確的是( )
A.相同類型的離子晶體,晶格能越大,形成的晶體越不穩定 B.中心原子的雜化方式取決于其配位原子的數目 C.用金屬的電子氣理論能合理的解釋金屬易腐蝕的原因 D.H3O+、NH4Cl 和[Ag(NH3)2]+中均存在配位鍵 組卷:76引用:2難度:0.6 -
4.某元素原子處于能量最低狀態時,外圍電子排布式為4d15s2,則下列說法正確的是( )
A.該元素原子最外層有3個電子 B.該元素原子核外共有5個電子層 C.該元素原子的M層共有8個電子 D.該元素原子處于能量最低狀態時,原子中共有3個未成對電子 組卷:6引用:1難度:0.6 -
5.設NA為阿伏加德羅常數的值,下列敘述中正確的是( )
A.冰晶體中平均每摩爾水分子最多含有2NA個氫鍵 B.12g石墨層狀結構中含有平面正六邊形的數目為NA C.5.6gFe溶于1L 0.3mol/L硝酸中,轉移的電子數為0.3NA D.1molN2和3molH2在一定條件下充分反應形成的N—H鍵數目為6NA 組卷:0引用:1難度:0.5 -
6.周期表中元素分區及位置與原子的結構密不可分,下列說法中正確的是( )
A.f區元素集中在第六周期ⅢB族 B.最外層電子排布為ns2的所有元素都分布在s區 C.最外層電子排布為ns1的所有元素都分布在 IA族 D.元素周期表中ⅢB族到ⅡB族10個縱行的元素都是金屬元素 組卷:3引用:2難度:0.8
第Ⅱ卷(非選擇題共52分)
-
19.CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等。已知:①CuCl可以由CuCl2用適當的還原劑如SO2、SnCl2等還原制得:
2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-△
2CuCl2+SNCl2=2CuCl↓+SnCl4
②CuCl2溶液與乙二胺(H2N-CH2-CH2-NH2)可形成配離子: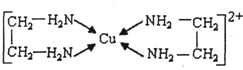
請回答下列問題:
(1)基態Cu原子的核外電子排布式為。H、N、O三種元素的電負性由大到小的順序是。
(2)SO2分子的空間構型為。與SnCl4互為等電子體的一種離子的化學式為。
(3)乙二胺分子中氮原子軌道的雜化類型為。乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高的多,原因是。
(4)②中所形成的配離子中含有的化學鍵類型有。(填字母)
a.配位鍵 b.極性鍵 c.離子鍵 d.非極性鍵
(5)CuCl的晶胞結構如右圖所示,其中Cl原子的配位數為。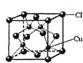 組卷:16引用:3難度:0.6
組卷:16引用:3難度:0.6 -
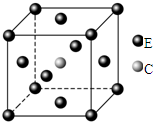 20.原子序數依次遞增且都小于36的A、B、C、D、E五種元素,其中A的一種核素中沒有中子,B原子基態時最外層電子數是其內層電子數的2倍,D原子基態時2p原子軌道上有2個未成對的電子,E元素的原子結構中3d能級上未成對電子數是成對電子數的2倍。回答下列問題:
20.原子序數依次遞增且都小于36的A、B、C、D、E五種元素,其中A的一種核素中沒有中子,B原子基態時最外層電子數是其內層電子數的2倍,D原子基態時2p原子軌道上有2個未成對的電子,E元素的原子結構中3d能級上未成對電子數是成對電子數的2倍。回答下列問題:
(1)B2A4分子中B原子軌道的雜化類型為,B2A4分子中σ鍵和π鍵個數比為。
(2)A、B、C、D四種元素的電負性從大到小的順序為(用元素符號表示);化合物CA3的沸點比化合物BA4的高,其主要原因是。
(3)元素B的一種氧化物與元素C的一種氧化物互為等電子體,元素C的這種氧化物的分子式是。
(4)元素E能形成多種配合物,如:E(CO)5等。
①基態E原子的價電子排布圖為。
②E(CO)5常溫下呈液態,熔點為-20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷E(CO)5晶體屬于(填晶體類型),該晶體中E的化合價為。
(5)E和C形成的一種化合物的晶胞結構如圖所示,該晶胞的化學式為。若兩個最近的E原子間的距離為acm,則該晶體的密度是g?mL-1。組卷:18引用:5難度:0.5


