2023年江蘇省無錫市江陰市夏港中學中考化學一模試卷
發布:2024/12/9 18:30:2
一、選擇題(本題包括20小題,每小題只有1個選項符合題意。1~10小題每小題1分,11~20小題每小題1分,共30分)
-
1.下列屬于純凈物的是( )
A.海水 B.水銀 C.青銅 D.石油 組卷:30引用:1難度:0.7 -
2.《天工開物》記載的下列造物過程中涉及化學變化的是( )
A.棉線織布 B.糧食釀酒 C.楠木制舟 D.沙里淘金 組卷:579引用:111難度:0.7 -
3.景泰藍制作工藝能將28克金拉成65公里長的金絲。該過程體現了金屬的性質是( )
A.導熱性 B.導電性 C.延展性 D.耐酸性 組卷:534引用:8難度:0.8 -
4.下列物質由離子構成的是( )
A.金 B.金剛石 C.干冰 D.氯化鈉 組卷:29引用:4難度:0.6 -
5.下列物質加入足量的水中,不能形成溶液的是( )
A.蔗糖 B.植物油 C.乙醇 D.氯化氫氣體 組卷:42引用:3難度:0.8 -
6.下列化學用語所表達的意義正確的是( )
A.硫離子:S-2 B.氧分子:O3 C.氬元素:Ar D.氯化鐵FeCl2 組卷:28引用:2難度:0.7 -
7.下列有關“水”的敘述中,正確的是( )
A.水是由氫氣和氧氣組成 B.通過活性炭的吸附可以將海水轉為淡水 C.用肥皂水可以區分硬水和軟水 D.電解水時,在負極產生的氣體質量是正極的2倍 組卷:29引用:1難度:0.7 -
8.下列有關實驗現象的描述正確的是( )
A.打開盛濃鹽酸瓶塞,有白煙冒出 B.稀硫酸能使紫色石蕊溶液變藍 C.稀鹽酸除鐵銹時,溶液變淺綠色 D.小木條蘸取濃硫酸后,小木條變黑 組卷:22引用:2難度:0.5 -
9.下列物質的用途與性質不對應的是( )
A.活性炭用作冰箱除味劑——吸附性 B.石墨常用來作電極——導電性 C.金剛石可用來切割玻璃——硬度大 D.武德合金制作保險絲——質軟 組卷:65引用:3難度:0.7
二、非選擇題共50分
-
27.金屬鐵及其制品是現代生活中不可缺少的材料和工具,在生產和生活中的應用極為廣泛。請用所學化學知識回答下列問題:
Ⅰ.鐵與鐵的化合物
(1)金屬在生產和生活中有著廣泛的用途,鐵是目前世界上使用最多的金屬。圖1是鐵原子的結構示意圖,其最外層電子數為。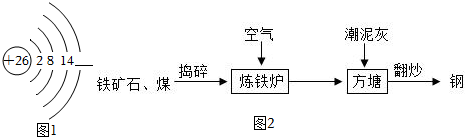
(2)鐵的化合物在現代更多領域發揮著重要作用,其中碳酸亞鐵(FeCO3)可作補血劑,服用后與胃酸反應生成的物質能促進血紅蛋白的生成,寫出碳酸亞鐵與胃酸反應的化學方程式。
Ⅱ.鋼鐵的冶煉
《天工開物》中記載的“炒鋼法”,該方法的生產過程如圖2所示:
【資料】潮泥灰主要成分是石灰石。
(3)在煉鐵爐中鼓入的空氣與礦物逆流而行的目的是。
(4)不斷翻炒液態生鐵,是為了降低元素的含量。
Ⅲ.金屬的銹蝕
(5)鐵生銹的原理:FeFe(OH)2O2、H2O①Fe(OH)3O2、H2O②Fe2O3?nH2O。風吹日曬③
Fe(OH)2轉化為Fe(OH)3的化學方程式。
(6)防止金屬生銹是金屬保護的有效方法之一,某學習小組設計了如圖3所示實驗(夾持裝置省略),探究鐵的銹蝕條件。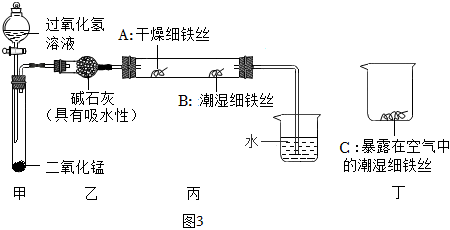
一段時間后觀察到,A處鐵絲依然光亮,B處鐵絲表面灰暗,C處鐵絲依然光亮,A、B處實驗現象對比,可得出鐵生銹與有關,B、C處實驗現象對比說明,決定鐵生銹快慢的一個重要因素是。組卷:190引用:1難度:0.6 -
28.侯德榜發明的侯氏制堿法為中國民族化學工業贏得了聲譽。
(1)侯氏制堿的主要產品是Na2CO3,其俗名是。
(2)實驗室模擬侯氏制堿,在濃氨水中加入NaCl粉末,配成飽和氨鹽水,用下列裝置制備NaHCO3,反應方程式為NaCl+NH3?H2O+CO2=NaHCO3↓+NH4Cl。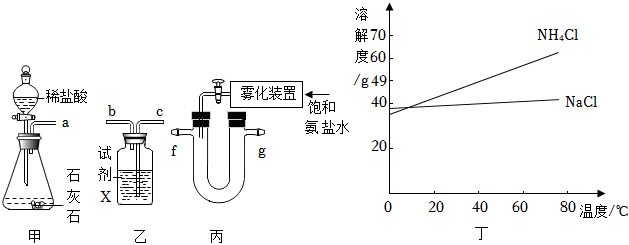
①甲裝置中分液漏斗的優點是,甲裝置錐形瓶中發生反應的化學方程式為。
②乙裝置中的試劑X用于吸收HCl,但不與CO2反應,則試劑X可為(填序號)。
A.濃硫酸
B.NaOH溶液
C.Ca(OH)2溶液
D.NaHCO3溶液
③乙裝置氣流的進氣接口為(填“b”或“c”)。
(3)分離丙裝置U形管內的混合物得到NaHCO3固體和NH4Cl溶液。
①灼燒NaHCO3發生反應2NaHCO3Na2CO3+H2O↑+CO2↑,若灼燒前后固體質量減少0.62g,則產品Na2CO3的質量為△g。(請寫出完整的計算過程)
②已知:NH4Cl和NaCl溶解度曲線如圖丁所示。
向NH4Cl溶液中加入NaCl粉末,可使NH4Cl結晶析出。為使剩余的NH4Cl和NaCl混合溶液中的NH4Cl充分結晶析出,比較適合采用的結晶方式是。組卷:97引用:1難度:0.7


