2021-2022學年黑龍江省八校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題一個選項符合題意,1-10每題2分,11-20每題3分共50分)
-
1.下列各組關于強電解質、弱電解質,非電解質的歸類,完全正確的是( )
選項 A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H3PO4 Fe(OH)3 非電解質 蔗糖 BaSO4 酒精 Cl2 A.A B.B C.C D.D 組卷:133引用:11難度:0.8 -
2.下列化學用語書寫正確的是( )
A.水溶液中NH4HSO4的電離方程式:NH4HSO4═NH4++H++SO42- B.水溶液中H2CO3的電離方程式:H2CO3?2H++CO32- C.NaHCO3溶液水解的離子方程式:HCO3-+H2O?CO32-+H3O+ D.AlCl3溶液水解的離子方程式:Al3++3H2O═Al(OH)3+3H+ 組卷:66引用:4難度:0.8 -
3.下列圖示與對應的敘述相符的是( )
A. 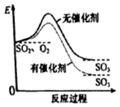
表示SO2氧化反應分別在有和無催化劑的情況下反應過程中的能量變化B. 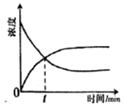
表示可逆反應物質的濃度隨時間的變化,且在t時刻達到平衡C. 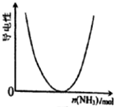
表示 CH3COOH溶液中通入NH3至過量的過程中溶液的導電性變化D. 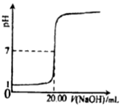
表示0.1000mol?-1NaOH溶液滴定20.00mL 0.1000mol?L-1HCl溶液的滴定曲線組卷:25引用:5難度:0.8 -
4.已知0.1 mol?L-1的醋酸溶液中存在電離平衡:CH3COOH?CH3COO-+H+,要使溶液中
增大,可以采取的措施是( )c(H+)c(CH3COOH)
①加少量燒堿固體
②升高溫度
③加少量冰醋酸
④加水
⑤加少量醋酸鈉固體A.②④ B.②③⑤ C.③④⑤ D.①② 組卷:112引用:7難度:0.6 -
5.下列說法與鹽類的水解有關的有幾項( )
①氯化銨與氯化鋅溶液可作焊接金屬過程中的除銹劑;
②用碳酸氫鈉與硫酸鋁兩種溶液可作泡沫滅火劑;
③配制硫酸亞鐵溶液時需加入少量鐵粉;
④實驗室盛放碳酸鈉溶液的試劑瓶不能用磨口玻璃塞;
⑤比較氯化銨和硫化鈉等鹽溶液的酸堿性;
⑥草木灰與銨態氮肥不能混合施用;
⑦Na2SO3溶液蒸干后得到Na2SO4固體。A.4項 B.5項 C.6項 D.7項 組卷:24引用:2難度:0.7 -
6.下列說法正確的是( )
A.已知2CO2(g)=2CO(g)+O2(g)反應的ΔH=+566.0 kJ?mol-1則CO(g)的燃燒熱:ΔH=-283.0 kJ?mol-1 B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ?mol-1,則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出57.3 kJ的熱量 C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,則a>b D.已知C(石墨,s)=C(金剛石,s) ΔH>0,則金剛石比石墨穩定 組卷:49引用:6難度:0.6 -
7.下列說法正確的是( )
A.pH試紙在使用之前應用蒸餾水潤濕 B.用廣泛pH試紙測某鹽酸的pH=2.3 C.常溫下反應2Na2SO3(s)+O2(g)═2Na2SO4(s)能自發進行,則ΔH<0 D.增大壓強(對于氣體反應),活化分子百分數增大,故反應速率增大 組卷:19引用:3難度:0.7 -
8.在一個恒容密閉容器中發生如下反應:A(g)+3B(g)?C(g),反應過程中某一時刻測得A、B、C的濃度分別為0.8mol?L-1、1.2mol?L-1、0.6mol?L-1,當反應達到最大限度時,可能出現的數據是( )
A.c(B)=3mol?L-1 B.c(A)=c(C)=0.5mol?L-1 C.c(A)=0.6mol?L-1 D.c(A)+c(C)=1.5mol?L-1 組卷:36引用:2難度:0.7
二、非選擇題(共50分)
-
23.研究發現,氮氧化物和硫氧化物是霧霾的主要成分。回答下列問題:
(1)已知某反應的平衡常數表達式為K=,請寫出此反應的化學方程式c(N2)c2(CO2)c2(NO)c2(CO)。
(2)向一個固定體積的密閉容器充入2molA和1molB,發生如下反應:2A(g)+B(g)?3C(g)+D(g)△H>0,2分鐘后,反應達到平衡,C的濃度為1.2mol/L。
①若在相同條件下,在上述容器中充入1.5molC和0.5molD發生上述反應,為使平衡后,C的濃度仍為1.2mol/L,則應再充入molA和molB。
②若在一體積可變的容器中,該反應達到平衡時,由于條件改變而引起反應速率和化學平衡的變化情況如圖1,a點改變的條件可能是。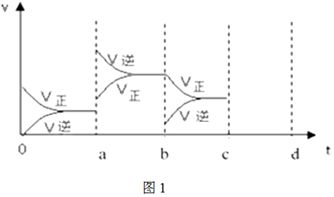
(3)FelixSludt等通過計算機模擬結果,研究了在Ni-Zn催化劑表面C2H2與H2催化加成反應生成乙烷的反應歷程(如圖2所示,其中吸附在Ni-Zn催化劑表面上的物種用■標注)。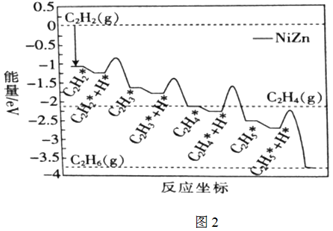
①該歷程中最大能壘(活化能)步驟的化學方程式為。
②在密閉容器中充入乙烯,一定條件下發生反應C2H4(g)?C2H2(g)+H2(g),為了提高乙烯的平衡轉化率,理論上可采取的措施是。
A.升高溫度
B.減小壓強
C.增大壓強
D.增加C2H4組卷:42引用:3難度:0.3 -
24.下表是幾種常見弱酸的電離平衡常數(25℃):
(1)根據分析表格中數據可知,H2CO3、CH3COOH、HClO三種酸的酸性從強到弱依次是化學式 H2CO3 CH3COOH HClO 電離平衡常數 K1=4.3×10-7
K2=5.6×10-111.8×10-5 3.0×10-8 。
(2)下列反應不能發生的是(填字母)。
A.CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH═CH3COO-+HClO
C.CO32-+2HClO═CO2↑+H2O+2ClO-
D.2ClO-+CO2+H2O═CO32-+2HClO
(3)25℃,一定濃度CH3COONa溶液的pH=9,該溶液呈堿性的原因(用離子方程式表示)。溶液中=c(CH3COO-)c(CH3COOH)。
(4)①100℃時,Kw=1.0×10-12,將amol?L-1的醋酸與0.01mol?L-1氫氧化鈉等體積混合,反應后溶液恰好顯中性,Ka=。
②該溫度下某溶液中水電離出的c(H+)=1.0×10-12mol?L-1的溶液pH為或。
(5)H+濃度相同的等體積的兩份溶液A和B,A為鹽酸,B為醋酸,分別和鋅反應,若最后僅有一份溶液中存在鋅,且放出氫氣的質量相同,則下列說法正確的是。
①反應所需要的時間B>A
②開始反應時的速率A>B
③參加反應的鋅的物質的量A=B
④反應過程的平均速率B>A
⑤鹽酸里有鋅剩余
⑥醋酸里有鋅剩余
A.③④⑥
B.②③⑥
C.③④⑤
D.①②⑤組卷:12引用:1難度:0.5


