2022-2023學年江蘇省南通市海安市高三(上)期初化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:(共13分,每題3分,共39分。每題只有一個選項最符合題意。)
-
1.化學與生產、生活密切相關。下列說法不正確的是( )
A.我國成功研制出多款新冠疫苗,采用冷鏈運輸疫苗,可以防止蛋白質變性 B.用聚乳酸塑料代替聚乙烯塑料,可以減少白色污染 C.北斗衛星導航系統由中國自主研發、獨立運行,其所用芯片的主要成分為SiO2 D.“神舟十三號”宇宙飛船返回艙所用高溫結構陶瓷,屬于新型無機非金屬材料 組卷:5引用:2難度:0.6 -
2.Mg(NH)2可發生水解:Mg(NH)2+2H2O→Mg(OH)2+N2H4↑。下列相關化學用語正確的是( )
A.第一電離能:N>O>Mg B.N2H4的結構式: 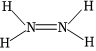
C.Mg2+的結構示意圖: 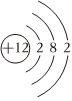
D.基態O原子核外電子軌道表示式 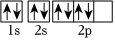 組卷:7引用:2難度:0.6
組卷:7引用:2難度:0.6 -
3.下列有關物質的性質與用途具有對應關系的是( )
A.HNO3具有強氧化性,可用于制備硝酸銨 B.SO2具有還原性,可用于紙漿漂白 C.Al2O3具有兩性,可用于電解冶煉鋁 D.NaHCO3溶液顯堿性,可用于制胃酸中和劑 組卷:12引用:3難度:0.6 -
4.NO2能與懸浮在大氣中的海鹽粒子作用,反應為2NO2+NaCl═NaNO3+ClNO(ClNO各原子均達到8電子穩定結構)。下列說法正確的是( )
A.NaNO3晶體屬于分子晶體 B.ClNO的結構式為Cl-N=O C.NaCl晶胞中Na+的配位數為12 D.NO2是由極性鍵構成的非極性分子 組卷:49引用:2難度:0.7 -
5.短周期主族元素X、Y、Z、W原子序數依次增大,且X、Z同主族,Y的基態原子中含11種運動狀態不同的電子,Z原子的最外層電子數與核外電子總數之比為3:8。下列說法正確的是( )
A.原子的半徑:r(X)<r(Y)<r(Z)<r(W) B.X與Y組成的化合物中均只含離子鍵 C.簡單氣態氫化物的沸點X的比Z的高 D.X、Y、W組成的化合物的水溶液一定呈堿性 組卷:21引用:2難度:0.5
二、解答題(共4小題,滿分61分)
-
16.高純碳酸錳在電子工業中有重要的應用,濕法浸出軟錳礦(主要成分為MnO2,含少量Fe、Al等雜質元素)制備高純碳酸錳的實驗過程如圖.
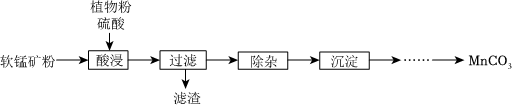
(1)“浸出”時,硫酸的作用是催化植物粉水解生成還原性糖。當硫酸濃度過高時,錳元素浸出率下降,其可能的原因是.
(2)“除雜”時主要操作為加入一定量的雙氧水,調節浸出液的pH為3.5~5.5,過濾。該過程中雙氧水實際用量比理論值大的原因是.
(3)“沉淀”:在30℃~35℃下,將碳酸氫銨溶液滴加到硫酸錳凈化液中,控制反應液的最終pH在6.5~7.0,得到MnCO3沉淀。該反應的化學方程式為;生成的MnCO3沉淀需經充分洗滌,檢驗洗滌是否完全的方法是.
(4)Mn3O4是黑色不溶于水的固體,常用于生產計算機的磁芯、磁盤等。已知:反應溫度和溶液pH對Mn3O4的純度和產率影響分別如圖-1、圖-2所示。請設計以硫酸錳凈化液為原料制備Mn3O4的實驗方案:,真空干燥4小時得產品Mn3O4。(實驗中須使用的試劑:氨水、空氣)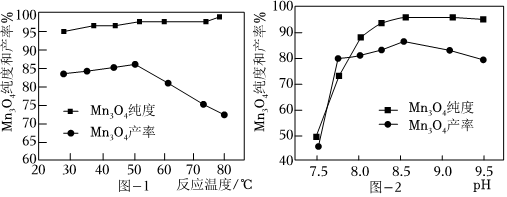 組卷:15引用:2難度:0.6
組卷:15引用:2難度:0.6 -
17.工業上常用微生物法、吸收法、電解法、還原法等消除硫、氮等引起的污染。
(1)微生物法脫硫
富含有機物的弱酸性廢水在SBR細菌作用下產生CH3COOH、H2等物質,可將廢水中還原為H2S,同時用N2或CO2將H2S從水中吹出,再用堿液吸收。SO2-4
①的空間構型為SO2-4.
②CH3COOH與在SBR細菌作用下生成CO2和H2S的離子方程式為SO2-4.
③將H2S從水中吹出時,用CO2比N2效果更好,其原因是.
(2)吸收法脫硫
煙氣中的SO2可以用“亞硫酸銨吸收法”處理,發生的反應為(NH4)2SO3+SO2+H2O═2NH4HSO3,測得25℃時溶液pH與各組分物質的量分數的變化關系如圖-1所示.b點時溶液pH=7,則n():n(NH+4)=HSO-3.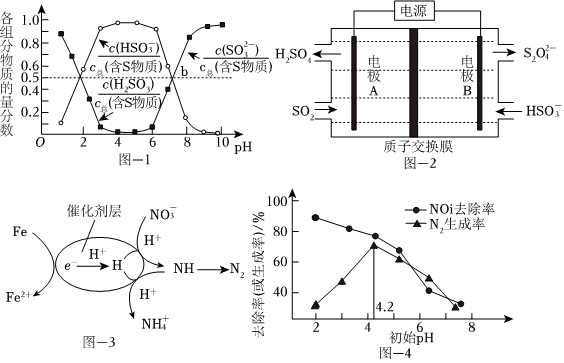
(3)電解法脫硫
用NaOH吸收后SO2,所得NaHSO3溶液經電解后可制取Na2S2O4溶液,反應裝置如圖-2所示。電解時每有1molS2生成有O2-4molH+透過質子交換膜。
(4)還原法脫氮
用催化劑協同納米零價鐵去除水體中。其催化還原反應的過程如圖-3所示。NO-3
①該反應機理中生成N2的過程可描述為.
②過程中去除率及N2生成率如圖-4所示,為有效降低水體中氮元素的含量,宜調整水體pH為4.2,當pH<4.2時,隨pH減小,N2生成率逐漸降低的原因是NO-3。組卷:43引用:4難度:0.5


