2021-2022學(xué)年四川省成都市蓉城高中教育聯(lián)盟高二(上)期末化學(xué)試卷
發(fā)布:2024/12/30 17:0:3
一、選擇題:本題共20小題,每小題2分,共40分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列儀器在酸性KMnO4溶液滴定H2C2O4溶液的實驗中不會用到的是( )
A. 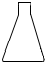
B. 
C. 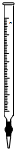
D.  組卷:22引用:1難度:0.5
組卷:22引用:1難度:0.5 -
2.下列方程式書寫錯誤的是( )
A.S2-的水解方程式:S2-+H2O?H2S+2OH- B.NaHSO4在水中的電離方程式:NaHSO4═Na++H++SO42- C.NH4+的水解方程式:NH4++H2O?NH3?H2O+H+ D.Fe3+的水解方程式:Fe3++3H2O?Fe(OH)3+3H+ 組卷:48引用:1難度:0.8 -
3.室溫下,某溶液中由水電離出的c(H+)?c(OH-)=10-24,下列離子一定能大量共存的是( )
A.K+、Na+、NO3-、SO42- B.Fe3+、K+、S2-、NO3- C.NH4+、S2-、CH3COO-、Cl- D.Na+、HSO3-、CO32-、Cl- 組卷:16引用:1難度:0.7 -
4.下列事實不能用勒夏特列原理解釋的是( )
A.實驗室常用排飽和食鹽水的方法收集氯氣催化劑 B.高壓有利于N2和H2轉(zhuǎn)化為NH3:N2(g)+3H2(g) 2NH3(g) ΔH<0催化劑高溫高壓C.由H2、I2蒸氣、HI組成的平衡體系加壓后顏色變深 D.在含有Fe(SCN)3的紅色溶液中加鐵粉,振蕩靜置,溶液顏色變淺或褪去 組卷:19引用:1難度:0.7 -
5.下列不能證明HA是弱電解質(zhì)的是( )
A.常溫下,NaA溶液的pH=9 B.常溫下,濃度均為0.1mol?L-1的HA和HCl溶液,后者導(dǎo)電能力明顯更強 C.0.1mol?L-1HA溶液的pH=3 D.HA溶液能與Na2CO3反應(yīng)產(chǎn)生CO2 組卷:80引用:3難度:0.7 -
6.化學(xué)反應(yīng)的速率是通過實驗測定的。下列說法錯誤的是( )
A.酸性KMnO4溶液和H2C2O4溶液反應(yīng),可以通過記錄溶液褪色時間來測定反應(yīng)速率 B.鋅與稀硫酸反應(yīng),可以通過測量一定時間內(nèi)產(chǎn)生的H2體積來計算反應(yīng)速率 C.可以依靠科學(xué)儀器測量光的吸收、光的發(fā)射、導(dǎo)電能力等來測定反應(yīng)速率 D.恒溫恒容條件下發(fā)生反應(yīng):CO(g)+H2O(g)?CO2(g)+H2(g),可以通過測量單位時間內(nèi)壓強的變化來測定反應(yīng)速率 組卷:40引用:1難度:0.5 -
7.實驗室利用如下方案探究影響化學(xué)反應(yīng)速率的因素。下列有關(guān)說法錯誤的是( )
實驗編號 溫度 酸性KMnO4溶液 H2C2O4溶液 ① 25℃ 0.01mol?L-1、4mL 0.1mol?L-1、2mL ② 25℃ 0.01mol?L-1、4mL 0.2mol?L-1、2mL ③ 25℃ 0.01mol?L-1、4mL 0.1mol?L-1、2mL ④ 25℃ 1mol?L-1、4mL 0.2mol?L-1、2mL A.實驗④反應(yīng)速率最快,褪色時間最短 B.實驗①②探究的是濃度對化學(xué)反應(yīng)速率的影響 C.如果起始時向①中加入MnSO4固體,反應(yīng)速率加快 D.該反應(yīng)的離子方程式為2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O 組卷:81引用:1難度:0.5 -
8.下列應(yīng)用未涉及到鹽類水解的是( )
A.用熱的純堿清洗油污 B.泡沫滅火器的使用原理 C.草木灰不宜與銨鹽氮肥混合施用 D.用醋酸清洗保溫瓶里的水垢 組卷:23引用:1難度:0.8
二、非選擇題:本題共5小題,共60分。
-
24.某學(xué)生用0.1000mol?L1NaOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
①移取25.00mL待測的鹽酸溶液注入潔凈的錐形瓶,并加入2~3滴酚酞;
②用標準溶液潤洗滴定管2~3次;
③取標準NaOH溶液注入滴定管至0刻度以上2~3cm;
④把盛有標準溶液的滴定管固定好,調(diào)節(jié)液面使滴定管尖嘴充滿溶液;
⑤調(diào)節(jié)液面至0刻度或0刻度以下,記下讀數(shù):
⑥把錐形瓶放在滴定管的下面,用標準NaOH溶液滴定至終點,記下滴定管液面的刻度。
(1)正確的操作順序是(填序號)。
(2)上述操作②的目的是。在進行操作④滴定前排氣泡時,應(yīng)選擇圖中的(填正確答案標號)。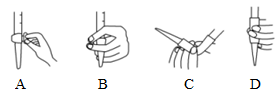
若用25mL滴定管進行實驗,當(dāng)?shù)味ü苤械囊好嬖凇?0”處時,管內(nèi)液體的體積(填正確答案標號)。
A.=10mL
B.=15mL
C.<10mL
D.>15mL
(3)步驟③中的滴定管是滴定管(填“酸式”或“堿式”)。
(4)當(dāng)步驟⑥中待測液由色變?yōu)?色,且半分鐘內(nèi)不變化即達到滴定終點。NaOH溶液開始時的讀數(shù)及滴定結(jié)束時的讀數(shù)如下表所示:
請計算滴定過程中消耗的V(NaOH)=實驗編號 待測鹽酸溶液體積(mL) 滴定開始讀數(shù)(mL) 滴定結(jié)束讀數(shù)(mL) i 25.00 0.00 19.95 ii 25.00 1.10 18.30 iii 25.00 0.20 20.25 ,待測的鹽酸的物質(zhì)的量濃度為(計算結(jié)果保留四位小數(shù))。
(5)下列操作會導(dǎo)致上述所測鹽酸溶液的濃度偏高的是(填正確答案標號)。
A.滴定達到終點時,俯視滴定管內(nèi)液面讀數(shù)
B.堿式滴定管用蒸餾水洗凈后立即取用氫氧化鈉溶液進行滴定
C.錐形瓶用蒸餾水洗凈后未干燥就裝入鹽酸待測液
D.滴定時堿式滴定管中氫氧化鈉溶液灑落在錐形瓶外組卷:29引用:1難度:0.8 -
25.(1)已知100℃時,水的離子積常數(shù)為1×10-12,該溫度下,有pH=11的NaOH溶液100mL,要使它的pH變?yōu)?0(體積變化忽略不計):
①如果加入蒸餾水,應(yīng)加mL;
②如果加入pH=9的NaOH溶液,應(yīng)加mL;
③如果加入0.01mol?L-1的鹽酸,應(yīng)加mL。
(2)在t℃時,測得0.01mol?L-1NaOH溶液的pH=11,0.1mol?L-1的HA溶液中=107。回答下列問題:c(H+)c(OH-)
①該溫度下,水的離子積常數(shù)Kw=;
②該溫度下,0.1mol?L-1的HA溶液中由水電離出的c(H+)=mol?L-1。
(3)①明礬溶液呈(填“酸性”“中性”或“堿性”),原因是(用離子方程式表示);
②將氯化鐵溶液蒸干灼燒得到的固體物質(zhì)是(填化學(xué)式)。組卷:33引用:1難度:0.7


