2021-2022學年遼寧省沈陽市東北育才雙語學校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個最佳選項,每小題3分,共計45分)
-
1.下列說法正確的有幾項( )
(1)AgCl難溶于水,故屬于弱電解質
(2)氨水中存在NH3?H2O分子,故氨水屬于弱電解質
(3)稀醋酸加水稀釋,電離程度和溶液的pH均增大
(4)稀氨水通入NH3,電離平衡向電離方向移動,溶液導電能力增強
(5)稀醋酸中加入CH3COONa固體,醋酸的電離程度減小,溶液導電能力增強
(6)對于0.1mol/L醋酸溶液,適當加熱,溶液中的值增大c(CH3COO-)c(CH3COOH)
(7)將液面在8.20mL處的25mL堿式滴定管中的NaOH溶液全部放出,其體積為16.80mL
(8)中和滴定實驗時,滴定管、錐形瓶均用待裝溶液潤洗
(9)測定中和熱時,應迅速將酸、堿稀溶液在有保溫措施的容器內混合、攪拌,記錄最后溫度
(10)用廣泛pH試紙測定NaClO溶液的pH為12A.3 B.4 C.5 D.6 組卷:26引用:1難度:0.7 -
2.氮及其化合物的轉化過程如圖1所示,其中如圖2為反應①過程中能量變化的曲線圖。
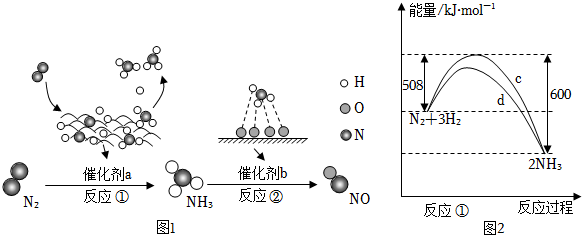
下列分析合理的是( )A.如圖2中c曲線是加入催化劑a時的能量變化曲線 B.反應①的熱化學方程式為:N2(g)+3H2(g)═2NH3(g)△H=-92 kJ/mol C.在反應②中,若有1.25 mol電子發生轉移,則參加反應的NH3的體積為5.6 L D.催化劑a、b能提高化學反應①、②的化學反應速率和平衡轉化率 組卷:54引用:7難度:0.9 -
3.一定溫度下,10mL 0.40mol/LH2O2溶液發生催化分解。不同時刻測得生成O2的體積(已折算為標準狀況)如下表。
下列敘述不正確的是(溶液體積變化忽略不計)( )t/min 0 2 3 6 8 10 V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 A.0~6min的平均反應速率:v(H2O2)≈3.3×10-2mol(L?min) B.6~10min的平均反應速率:v(H2O2)<3.3×10-2mol(L?min) C.反應至6min時,c(H2O2)=0.30mol?L-1 D.反應至6min時,H2O2分解了50% 組卷:89引用:12難度:0.9 -
4.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - B. =1×10-12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)C.c(Fe2+)=1mol?L-1的溶液中:K+、NH4+、MnO4-、SO42- D.能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3- 組卷:2938引用:36難度:0.7 -
5.近期發現,H2S是繼NO、CO之后的第三個生命體系氣體信號分子,它具有參與調節神經信號傳遞、舒張血管減輕高血壓的功能.下列事實中,不能比較氫硫酸與亞硫酸的酸性強弱的是( )
A.氫硫酸不能與碳酸氫鈉溶液反應,而亞硫酸可以 B.氫硫酸的導電能力低于相同濃度的亞硫酸 C.0.10mol/L的氫硫酸和亞硫酸的pH分別為4.5和21 D.氫硫酸的還原性強于亞硫酸 組卷:21引用:3難度:0.7 -
6.E和F加入密閉容器中,在一定條件下發生反應:E(s)+4F(g)?G(g),已知該反應的平衡常數值如下表所示.下列說法正確的是( )
溫度℃ 25 80 230 平衡常數值 5×104 2 1.9×10-5 A.上述反應是熵增反應 B.25℃時,反應G(g)?E(s)+4F(g)的平衡常數值是0.5 C.在80℃時,測得某時刻,F、G濃度均為0.5 mol?L-1,則此時v(正)>v(逆) D.恒溫恒容下,向容器中再充入少量G(g),達新平衡時,G的體積百分含量將增大 組卷:773引用:7難度:0.7
三.實驗題
-
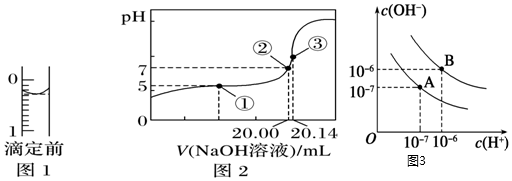
18.某同學用0.1000mol?L-1NaOH溶液滴定20.00mL某濃度的CH3COOH溶液。
(1)部分操作如下:
①取一支用蒸餾水洗凈的堿式滴定管,加入標準氫氧化鈉溶液,記錄初始讀數;
②用酸式滴定管放出一定量待測液,置于用蒸餾水洗凈的錐形瓶中,加入2滴甲基橙;
③滴定時,邊滴加邊振蕩,同時注視滴定管內液面的變化。
請選出上述操作過程中存在錯誤的序號:。
(2)某次滴定前滴定管液面如圖1所示,讀數為mL。
(3)根據實驗結果所繪制的滴定曲線如圖2所示,其中點①所示溶液中c(CH3COO-)=1.7c(CH3COOH),點③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。計算醋酸的電離常數:,該CH3COOH的物質的量濃度為mol?L-1。
(4)水的電離平衡曲線如圖3所示。若以A點表示25℃時水在電離平衡時的離子濃度,當溫度升到100℃時,水的電離平衡狀態到B點,則此時水的離子積。將常溫下的pH=8的Ba(OH)2溶液與常溫下的pH=5的稀鹽酸混合,并保持100℃的恒溫,欲使混合溶液pH=7,則Ba(OH)2與鹽酸的體積比為。組卷:35引用:2難度:0.6
四、原理綜合題
-
19.苯乙烯是重要的有機合成單體,常用乙苯為原料合成:
(1)以CO2和乙苯為原料合成的苯乙烯,反應為: +CO2(g)?
+CO2(g)?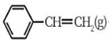 +CO(g)+H2O(g)△H>0
+CO(g)+H2O(g)△H>0
其反應歷程如圖: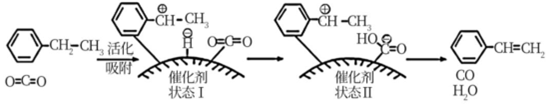
①由原料到狀態Ⅰ(填“放出”或“吸收”)能量。上述過程中,能量的變化形式是由
轉化為。
②乙苯平衡轉化率與p(CO2)的關系如圖1所示,開始時隨著二氧化碳壓強增大,二氧化碳濃度增大,乙苯平衡轉化率增大;二氧化碳壓強繼續增大,乙苯平衡轉化率隨著p(CO2)的增大反而減小,試解釋乙苯平衡轉化率減小的原因。
(2)某研究團隊找到乙苯直接脫氫的高效催化劑,反應原理如下: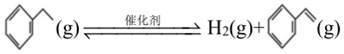 △H1
△H1
①已知部分化學鍵鍵能數據如表所示:
則△H1=共價鍵 C-C C-H C═C H-H 鍵能(kJ/mol) 347.7 413.4 615 436 。若該反應的活化能Ea(正)為akJ/mol,則該反應逆反應的活化能Ea(逆)為kJ/mol(用△H1和a表示)
②其他條件不變時,在不同催化劑(n、m、p)作用下,反應進行相同時間后,乙苯的轉化率隨反應溫度的變化如圖2所示。相同溫度下,三種催化劑(n、m、p)的催化活性由高到低的順序為;b點乙苯的轉化率高于a點的原因是。組卷:14引用:2難度:0.5


