2021-2022學年福建省福州市協作體四校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(每小題只有一個正確選項,16題,每小題3分,共48分)
-
1.在相同條件下,燃燒時對大氣污染程度最小是( )
A.煤油 B.柴油 C.木材 D.液化氣 組卷:28引用:2難度:0.8 -
2.下列反應屬于放熱反應的是( )
A.氫氧化鉀和硫酸中和 B.電解水 C.碳酸鈣高溫分解成氧化鈣和二氧化碳 D.氫氣還原氧化銅 組卷:34引用:2難度:0.5 -
3.對于反應2A2(g)+B(S)?2C(g),能增大正反應速率的措施是( )
A.加入少量B物質 B.增大容器容積 C.恒容時充入Ar氣體 D.升高體系的溫度 組卷:35引用:2難度:0.8 -
4.反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在5L密閉容器中進行,半分鐘后,NO的物質的量增加了0.3mol,則此反應的平均速率為( )
A.V(O2)=0.01 mol/(L?s) B.V(NO)=0.008 mol/(L?s) C.V(H2O)=0.003 mol/(L?s) D.V(NH3)=0.004 mol/(L?s) 組卷:59引用:16難度:0.7 -
5.石墨和金剛石都是碳的單質,石墨在一定條件下可轉化為金剛石。已知12克石墨完全轉化成金剛石時,要吸收1.9kJ 的能量。下列說法正確的是( )
A.石墨不如金剛石穩定 B.金剛石不如石墨穩定 C.等質量的石墨所具有的能量比金剛石高 D.等質量的石墨與金剛石完全燃燒,石墨放出的能量更多 組卷:13引用:3難度:0.7 -
6.下列說法正確的是( )
A.增大壓強,活化分子百分數增大,化學反應速率一定增大 B.升高溫度,活化分子百分數增大,化學反應速率可能增大 C.加入反應物,使活化分子百分數增大,化學反應速率增大 D.使用正催化劑可以降低反應的活化能,增大活化分子百分數,增大化學反應速率 組卷:90引用:11難度:0.9 -
7.已知0.1 mol硫黃完全燃燒時放出的熱量為29.6kJ,對應的熱化學方程式是( )
A.S+O2═SO2 ΔH=-296kJ?mol-1 B.S(s)+O2(g)═SO2(g) ΔH=-29.6kJ?mol-1 C.S(s)+O2(g)═SO2(g) ΔH=-296kJ?mol-1 D.S(s)+O2(g)═SO2(g) ΔH=+296kJ?mol-1 組卷:20引用:4難度:0.7
二、填空題(共6小題,每小題6分,滿分43分)
-
21.如表是研究性學習小組研究影響過氧化氫(H2O2)分解速率的因素時采集的一組數據:用10mL H2O2溶液制取150mL氧氣所需的時間(單位:s)
請回答下列問題:
濃 度
反應條件30% H2O2 15% H2O2 10% H2O2 5% H2O2 無催化劑、不加熱 幾乎不反應 幾乎不反應 幾乎不反應 幾乎不反應 無催化劑、加 熱 360 480 540 720 MnO2催化劑、加熱 10 25 60 120
(1)該研究小組在設計方案時,考慮了濃度、、等反應條件對過氧化氫分解速率的影響.
(2)從上述影響過氧化氫分解速率的三個因素說明這些因素對分解速率有何影響?;;.組卷:38引用:6難度:0.5 -
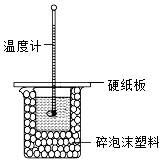 22.其實驗小組用50 mL0.50mol?L-1NaOH 溶液和50mL0.55mol?L-1鹽酸溶液進行中和反應的反應熱的測定。測定鹽酸和稀氫氧化鈉反應中和熱的實驗裝置如圖所示。
22.其實驗小組用50 mL0.50mol?L-1NaOH 溶液和50mL0.55mol?L-1鹽酸溶液進行中和反應的反應熱的測定。測定鹽酸和稀氫氧化鈉反應中和熱的實驗裝置如圖所示。
(1)該裝置缺少一種玻璃儀器,該儀器的名稱為。
(2)寫出該反應的熱化學方程式(中和反應的反應熱△H=-57.3mol?L-1):
(3)實驗數值結果與57.3mol?L-1相比偏小,產生偏差的原因可能是。
a.實驗裝置保溫、隔熱效果差
b.量取 NaOH溶液的體積時仰視讀數
c.分多次把 NaOH溶液倒入盛有鹽酸的小燒杯中
d.測定NaOH溶液起始溫度后的溫度計未洗滌,直接再測定鹽酸溶液的溫度組卷:4引用:2難度:0.7


