2021-2022學年江西省九校高二(上)期中化學試卷
發布:2024/11/15 11:0:2
一、單選題(每題3分,合計48分)
-
1.2021年6月17日,神舟十二號載人飛船成功將3名航天員送入中國空間站,這是中國人首次進入自己的空間站。下列說法錯誤的是( )
A.太陽電池翼伸展機構用到的SiC是一種新型硅酸鹽材料 B.空間站中用Na2O2將CO2轉化為O2,Na2O2含離子鍵和非極性鍵 C.運載火箭的燃料偏二甲肼( C2H8N2)燃燒過程中化學能轉化為熱能 D.天和核心艙采用電推發動機“燃料” Xe原子核含77個中子13154組卷:16引用:5難度:0.8 -
2.下列各組關于強電解質、弱電解質、非電解質的歸類,完全正確的是( )
A B C D 強電解質 Fe NaCl CaCO3 HNO3 弱電解質 CH3COOH NH3 H3PO4 Fe(OH)3 非電解質 C12H22O11
(蔗糖)BaSO4 C2H5OH
(酒精)H2O A.A B.B C.C D.D 組卷:117引用:14難度:0.7 -
3.將濃度為0.1mol?L-1的HF溶液不斷加水稀釋(保持溫度不變),下列各量始終保持增大的是( )
A. c(F-)c(OH-)B.Ka(HF) C. c(HF)c((F-)D. c(H+)c((HF)組卷:15引用:1難度:0.7 -
4.化學家格哈德?埃特爾證實了氫氣與氮氣在固體催化劑表面合成氨的反應過程,示意圖如下:
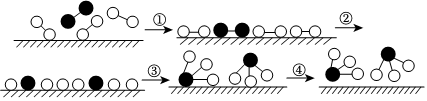
下列關于合成氨反應的敘述中不正確的是( )A.該過程表明,在化學反應中存在化學鍵的斷裂與形成 B.在催化劑的作用下,反應物的化學鍵變得容易斷裂 C.過程②需吸收能量,過程③則放出能量 D.常溫下該反應難以進行,是因為常溫下生成物的化學鍵難以形成 組卷:130引用:19難度:0.7 -
5.下列有關有效碰撞理論和活化能的認識,不正確的是( )
A.增大壓強(對于氣體反應),活化分子總數增大,故反應速率增大 B.溫度升高,活化分子百分數增加,增加了碰撞頻率,故反應速率增大 C.選用適當的催化劑,降低活化能,活化分子百分數增加,碰撞頻率增加,故反應速率增大 D.H+和OH-的反應活化能非常小,反應幾乎在瞬間完成 組卷:30引用:1難度:0.7 -
6.用下列實驗裝置能達到相關實驗目的的是( )
A. 
用圖裝置制備氫氧化鐵膠體B. 
用圖裝置檢驗溶液中是否含有K+C. 
用圖裝置灼燒碎海帶D. 
用圖裝置測定中和反應的反應熱組卷:14引用:5難度:0.5 -
7.在恒容密閉容器中,進行如下反應:NO(g)+CO(g)?
N2(g)+CO2(g);△H=-373.2kJ?mol-1達到平衡后,為提高NO的轉化率,采取的正確措施是( )12A.加催化劑 B.充入CO增大壓強 C.充入N2 D.升高溫度 組卷:40引用:4難度:0.6
二、填空題
-
21.二氧化硫和氮的氧化物是常用的化工原料,但也是大氣的主要污染物。綜合治理其污染是環境化學當前的重要研究內容之一。
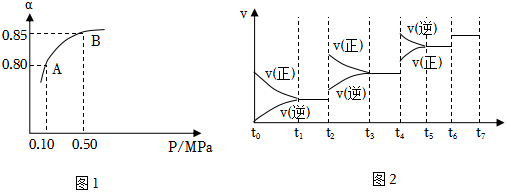
【Ⅰ】硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g)2SO3(g)催化劑△
某溫度下,SO2的平衡轉化率(α)與體系總壓強(P)的關系如圖1所示。根據圖示回答下列問題:
①寫出該反應的化學平衡常數表達式:
②將2.0mol SO2和1.0mol O2置于10L密閉容器中,反應達平衡后,體系總壓強為0.10MPa.該反應的平衡常數等于。
③平衡狀態由A變到B時。平衡常數K(A)K(B)(填“>”、“<”或“=”)。
【Ⅱ】(1)用CH4催化還原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用標準狀況下4.48L CH4還原NO2至N2整個過程中轉移的電子總數為(阿伏加德羅常數的值用NA表示),放出的熱量為:kJ。
高溫
(2)氮化硅(Si3N4)是一種新型陶瓷材料,它可由石英與焦炭在高溫的氮氣流中,通過以下反應制得:
3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
達到平衡后,改變某一外界條件(不改變N2、CO的量),反應速率υ與時間t的關系如圖2.圖中t4時引起平衡移動的條件可能是;圖中表示平衡混合物中CO的含量最高的一段時間是。組卷:3引用:3難度:0.5 -
22.為了研究碳酸鈣與鹽酸反應的反應速率。
Ⅰ、甲同學通過如圖1實驗裝置測定反應中生成的CO2氣體體積,并繪制出如圖2所示的曲線.請分析討論以下問題。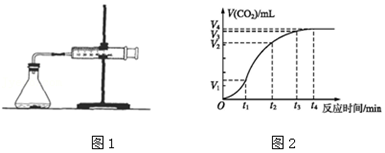
①化學反應速率最快的時間段是,影響此時間段反應速率的主要因素是;
A.O~t1
B.t1~t2
C.t2~t3
D.t3~t4
②為了減緩上述反應速率,欲向鹽酸中加入下列物質,你認為可行的有;
A.蒸餾水
B.NaCl固體
C.NaCl溶液
D.通入HCl
③若鹽酸的體積是20mL,圖中CO2的體積是標準狀況下的體積,則t1~t2時間段平均反應速率v(HCl)=mol?(L?min)-1。
Ⅱ、乙同學擬用如圖裝置探究固體表面積和反應物濃度對化學反應速率的影響。
限選試劑與用品:1mol/LHCl、顆粒狀CaCO3、粉末狀CaCO3、蒸餾水、量筒、秒表。
①設計實驗方案:在固體表面積或反應物濃度不同的條件下,測定(要求所測得的數據能直接體現反應速率大小)。
②完成實驗表格(除反應時間需測定),以完整體現實驗方案。
則V1=物理量
實驗序號V(mL)(1mol/LHCl) m(顆粒狀CaCO3質量)(g) m(粉末狀CaCO3質量)(g) V(蒸餾水)(mL) m(CO2)(g) 反應時間t(s) ① 10.0 5.0 0 10.0 2.0 ② V1 0 5.0 V2 2.0 ③ 20.0 b 0 V3 2.0 mL,b=g,兩組(填實驗序號)可比較濃度對反應速率影響,兩組(填實驗序號)可比較固體表面積對反應速率影響。組卷:31引用:2難度:0.6


