2021-2022學年廣東省廣州大學附中高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題目要求,每小題2分,共25小題,共50分)
-
1.下列措施是為了降低化學反應速率的是( )
A.食品放在冰箱中貯藏 B.合成氨工業中使用催化劑 C.用鋅粉代替鋅片與稀硫酸反應制取氫氣 D.在試管中進行鋁和鹽酸反應時,稍微加熱 組卷:42引用:4難度:0.5 -
2.下列敘述不正確的是( )
A.用天然氣火力發電時,每一步都需要化學反應來完成 B.利用太陽能等清潔能源代替化石燃料,有利于節約資源,保護環境 C.原電池反應一定為氧化還原反應 D.在火力發電時,化學能轉化為熱能的過程實際上是氧化還原反應發生的過程,伴隨著能量的變化 組卷:46引用:3難度:0.7 -
3.碳納米管是繼足球烯(C60)以后發現的又一種碳單質,以下有關碳納米管與足球烯(C60)的說法錯誤的是( )
A.它們的物理性質有較大差異 B.在常溫下它們的化學性質都穩定 C.它們是不同的碳單質 D.它們分別完全燃燒后生成物不同 組卷:71引用:6難度:0.8 -
4.如圖表示化學反應過程中的能量變化,據圖判斷下列說法中合理的是( )
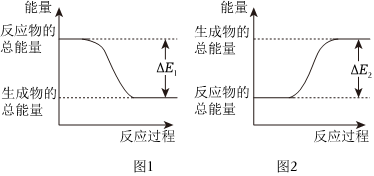
A.氯化銨和氫氧化鋇晶體反應,其能量變化符合圖1 B.和0.1molH2SO4溶液和0.1molBa(OH)2溶液的反應符合圖2,且吸收熱量為E2 C.0.1molHCl溶液和0.1molNaOH溶液的反應符合圖1,且放出熱量為ΔE1 D.發生圖1能量變化的任何反應,一定不需要加熱即可發生 組卷:16引用:1難度:0.6 -
5.過量鐵與少量稀硫酸反應,為了加快反應速率,但是又不影響生成氫氣的總量,可以采取的措施是( )
A.加入幾滴硫酸銅溶液 B.加入適量的水 C.加入適量NaCl溶液 D.再加入少量稀硫酸 組卷:21引用:5難度:0.5 -
6.下列說法中,不正確的是( )
A.化學反應一定伴隨能量變化 B.化學反應中的能量變化一定是由化學鍵變化引起的 C.有新物質生成是化學反應的根本特征 D.化學反應中能量變化的大小與反應物的多少有關 組卷:25引用:2難度:0.7 -
7.N2和H2在催化劑表面合成氨的微觀歷程及能量變化的示意圖如下,用
 、
、 、
、 分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法不正確的是( )
分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法不正確的是( )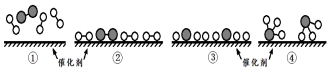
A.②→③過程,是吸熱過程 B.③→④過程,N原子和H原子形成了含有極性鍵的NH3 C.合成氨反應中,反應物斷鍵吸收的能量大于生成物形成新鍵釋放的能量 D.合成氨反應中,反應物總能量大于生成物總能量 組卷:55引用:6難度:0.7 -
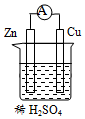 8.Zn-Cu原電池結構如圖所示,下列關于此裝置的敘述正確的是( )
8.Zn-Cu原電池結構如圖所示,下列關于此裝置的敘述正確的是( )A.Zn是正極,Cu是負極 B.電子從Zn極沿導線流向Cu極 C.Cu極發生了氧化反應 D.Zn極有氣體放出,溶液pH變大 組卷:32引用:2難度:0.7 -
9.燃料電池是目前電池研究的熱點之一。現有某課外小組自制的氫氧燃料電池,如圖所示,a、b均為惰性電極。下列敘述不正確的是( )
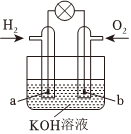
A.a極是負極,該電極上發生氧化反應 B.電池總反應為2H2+O2═2H2O C.b極電極反應式為O2+4e-+4OH-═2H2O D.氫氧燃料電池是一種具有廣闊應用前景的綠色電源 組卷:59引用:3難度:0.6
二、非選擇題(共50分
-
27.氮化硅硬度大、熔點高、不溶于酸(氫氟酸除外),是一種重要的結構陶瓷材料。一種用工業硅(含少量鉀、鈉、鐵、銅的氧化物),已知硅的熔點是1420℃,高溫下氧氣及水蒸氣能明顯腐蝕氮化硅。一種合成氮化硅的工藝流程如圖。
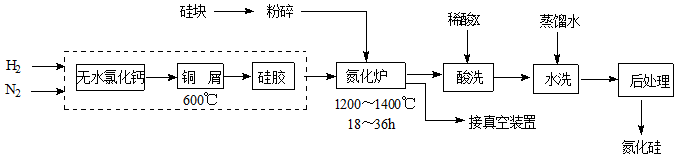
注:原料中的N2是采用空氣分離法制備。
(1)凈化N2和H2時,銅屑的作用是;硅膠的作用是。
(2)氮化爐中發生反應:3SiO2(s)+2N2(g)═Si3N4(s),同時會劇烈放熱,反應時要嚴格控制氮氣的流速以控制,原因是。
(3)X可能是。(選填:“鹽酸”、“硝酸”、“硫酸”、“氫氟酸”)
(4)如何說明氮化硅產品已用水洗干凈?。
(5)用硅粉作硅源、疊氮化鈉(NaN3)作氮源,直接燃燒生成氮化硅(發生置換反應),該反應的化學方程式為:。組卷:26引用:3難度:0.5 -
28.S是一種重要的非金屬元素,其單質及化合物在人類日常生產生活中起著重要的作用。
Ⅰ.探究一定條件下反應物濃度對硫代硫酸鈉(Na2S2O3)與硫酸反應速率的影響。
【查閱資料】
a.Na2S2O3易溶于水,能與硫酸發生反應:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O
b.濁度計用于測量渾濁度的變化。產生的沉淀越多,渾濁度(單位為NTU)值越大。
【實驗過程】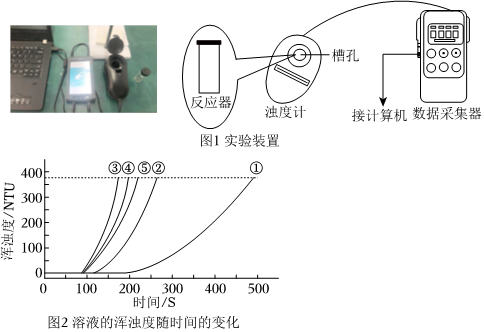
用圖1所示裝置進行如下表所示的5個實驗,分別測量混合后溶液達到相同渾濁度的過程中,渾濁度隨時間的變化。實驗①~⑤所得數據如圖2曲線①~⑤所示。
實驗數據:實驗編號 Na2S2O3溶液 H2SO4溶液 蒸餾水 c/(mol?L-1) V/mL c/(mol?L-1) V/mL V/mL ① 0.1 1.5 0.1 3.5 10 ② 0.1 2.5 0.1 3.5 9 ③ 0.1 3.5 0.1 3.5 x ④ 0.1 3.5 0.1 2.5 9 ⑤ 0.1 3.5 0.1 1.5 10
【分析與解釋】
(1)選用濁度計進行測量,原因是Na2S2O3溶液與H2SO4溶液反應生成了。
(2)實驗③中,x=。
(3)實驗①、②、③的目的是。
(4)通過比較①、②、③與③、④、⑤兩組實驗,可推斷:反應物濃度的改變對Na2S2O3與硫酸反應的化學反應速率的影響,Na2S2O3溶液濃度的改變影響更大。該推斷的證據是。
Ⅱ.目前,NaClO溶液廣泛地應用于脫硫脫硝。
(5)某課外小組同學設計了如圖噴淋吸收塔裝置(如圖3),設計該裝置的優點是。
(6)如圖4為NaClO濃度對脫硫脫硝效率(η/%)的影響。當溫度為50℃,溶液的pH=10,c(SO2)=c(NO)=300mg?m-3,SO2的脫除效率一直維持在98%以上,而NO脫除效率相對較低,其原因是。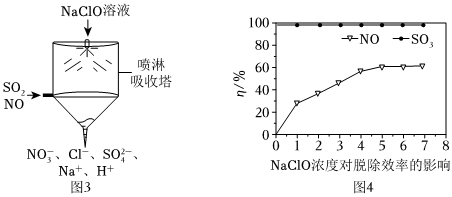
Ⅲ.研究表明,ZnO水懸濁液能有效地吸收SO2,然后再經O2催化氧化,可得到硫酸鹽。
已知:室溫下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、,HSO-3的物質的量分數(物質的量分數=SO2-3×100%)隨pH的分布如圖5所示。某含硫粒子的物質的量含硫粒子總物質的量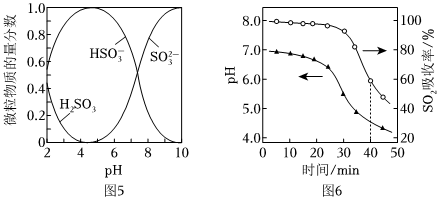
(7)向ZnO水懸濁液中勻速緩慢通入SO2,在開始吸收的40min內,SO2吸收率、溶液pH均經歷了從幾乎不變到迅速降低的變化(如圖6)。溶液pH幾乎不變階段,主要產物是(填化學式);SO2吸收率迅速降低階段,主要反應的離子方程式為。組卷:50引用:2難度:0.5


