2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷0023
發布:2025/1/6 6:30:3
一、選擇題:(本大題共18小題,每題3分,共54分,每小題只有一個正確答案。)
-
1.已知某物質顏色的強弱與該物質的濃度成正比、與觀察者的視程中的物質厚度成正比。在注射器中,存在NO2與N2O4的混合物,氣體呈棕色,現將注射器的針筒慢慢往外拉,保持溫度不變,此時混合物的顏色為( )
A.從針筒的垂直方向觀察,氣體顏色變深 B.從針筒的頂端方向觀察,氣體顏色變淺 C.從針筒的垂直方向觀察,氣體顏色沒有變化 D.從針筒的頂端方向觀察,氣體顏色變深 組卷:136引用:1難度:0.3 -
 2.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,下列各反應熱關系中不正確的是( )
2.已知化學反應的熱效應只與反應物的初始狀態和生成物的最終狀態有關,下列各反應熱關系中不正確的是( )A.A→F△H=-△H6 B.A→D△H=△H1+△H2+△H3 C.△H1+△H2+△H3+△H4+△H5+△H6=0 D.△H1+△H6=△H2+△H3+△H4+△H5 組卷:39引用:5難度:0.7 -
3.下列說法正確的是( )
A.增大壓強,活化分子百分數增大,化學反應速率一定增大 B.升高溫度,活化分子百分數增大,化學反應速率一定增大 C.加入反應物,使活化分子百分數增大,化學反應速率增大 D.使用催化劑,降低了反應的活化能,使活化分子百分數增大,反應速率不一定增大 組卷:81引用:2難度:0.5 -
4.下列不能用勒夏特列原理解釋的事實是( )
A.紅棕色的NO2加壓后顏色先變深后變淺 B.氫氣、碘蒸氣、碘化氫氣體組成的平衡體系加壓后顏色變深 C.黃綠色的氯水光照后顏色變淺 D.合成氨工業使用高壓以提高氨的產量 組卷:43引用:6難度:0.6 -
5.一定條件下,在體積為10L的密閉容器中充入1molX和1molY進行反應:2X(g)+Y(g)?Z(g),60s后反應達到平衡,生成Z的物質的量為0.3mol。下列說法正確的是( )
A.X的平衡轉化率為40% B.若將容器體積變為20 L,則Z的平衡濃度小于原來的 12C.若增大壓強,則Y的平衡轉化率減小 D.若升高溫度,X的體積分數增大,則該反應的△H>0 組卷:107引用:13難度:0.9 -
6.現用氯水來制取含有次氯酸的溶液,既要提高溶液中HClO物質的量濃度,又要降低溶液中HCl濃度,下列措施可以采用的是( )
A.加熱揮發HCl B.加水使平衡向正反應方向移動 C.加NaOH中和HCl D.加CaCO3中和HCl 組卷:57引用:6難度:0.9 -
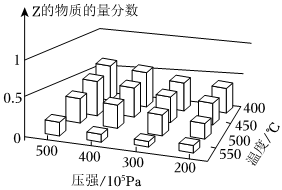 7.為探究外界條件對反應:mA(g)+nB(g)?cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )
7.為探究外界條件對反應:mA(g)+nB(g)?cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )A.ΔH>0 B.m+n<c C.升高溫度,υ正、υ逆都增大,平衡常數減小 D.恒溫恒壓時,向已達平衡的體系中加入少量Z(g),再次達到平衡后Z的物質的量分數增大 組卷:39引用:9難度:0.5
二、非選擇題(本題包括4小題,每空2分,共46分)
-
21.亞硝酰硫酸(NOSO4H)主要用于染料、醫藥等工業。實驗室用如圖裝置(夾持裝置略)制取少量的NOSO4H,并檢驗產品純度。已知:NOSO4H遇水水解,但溶于濃硫酸而不分解。

(1)利用裝置A制取SO2,下列最適宜的試劑是(填下列字母編號)
A.Na2SO3固體和20%硝酸 B.Na2SO3固體和20%硫酸
C.Na2SO3固體和70%硫酸 D.Na2SO3固體和18.4mol/L硫酸
(2)裝置B中濃HNO3和SO2在濃H2SO4作用下反應制得NOSO4H。
①為了控制通入SO2的速率,可以采取的措施是。
②該反應必須維持體系溫度不低于20℃.若溫度過高,產率降低的可能原因是。
③開始反應緩慢,待生成少量NOSO4H后,溫度變化不大,但反應速率明顯加快,其原因可能是。
(3)在實驗裝置存在可能導致NOSO4H產量降低的缺陷是。
(4)測定NOSO4H的純度
準確稱取1.337g產品加入250mL碘量瓶中,加入0.1000mol/L、60.00mL的KMnO4標準溶液和10mL 25%H2SO4溶液,然后搖勻。用0.2500mol/L草酸鈉標準溶液滴定,消耗草酸鈉溶液的體積為20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O═K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:+MnO-4C2+O2-4═Mn2+++H2O
②亞硝酰硫酸的純度=%(計算結果保留兩位有效數字)組卷:10引用:3難度:0.5 -
22.鉬酸鈉晶體(Na2MoO4?2H2O)是一種無公害型冷卻水系統的金屬緩蝕劑。工業上利用鉬精礦(主要成分是不溶于水的MoS2)制備鉬酸鈉的兩種途徑如圖所示:

(1)途徑Ⅰ還原劑與氧化劑物質的量之比為(不考慮雜質的反應);堿浸時氣體A的電子式為。
(2)途徑Ⅱ氧化時溶液中還有Na2SO4生成,則反應的離子方程式為。
(3)已知途徑Ⅰ的鉬酸鈉溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.40mol/L.由鉬酸鈉溶液制備鉬酸鈉晶體時,需加入Ba(OH)2固體以除去CO32-.當CO32-的除去率為90%時,列式計算此時是否有BaMoO4沉淀生成。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的體積變化]
(4)途徑Ⅱ所得的NaMoO4溶液結晶后再經過重結晶可使鉬酸鈉晶體的純度提高,其利用的原理是。
(5)某鋰電池放電過程中,電極上發生Lix(MoS2)n與MoS2之間的轉化。則電池放電時正極的電極反應式為。組卷:8引用:3難度:0.9


