2021-2022學年天津市河北區高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.下列有關能量變化的說法中錯誤的是( )
A.化學變化必然伴隨能量變化 B.化學變化中的能量變化主要由化學鍵的斷裂和形成引起 C.若反應物的總能量高于生成物的總能量,則該反應是吸熱反應 D.1mol石墨轉化為金剛石。要吸收1.9kJ的熱能,則石墨比金剛石穩定 組卷:163引用:1難度:0.7 -
2.根據熱化學方程式S(s)+O2(g)═SO2(g) ΔH=-297.2kJ/mol分析,下列說法中不正確的是( )
A.S(s)在O2(g)中燃燒是放熱反應 B.反應S(g)+O2(g)═SO2(g)的ΔH大于-297.2kJ/mol C.16g固體硫在空氣中充分燃燒,可放出148.6kJ的熱量 D.1molSO2(g)所具有的能量小于1molS(s)與1molO2(g)所具有的能量之和 組卷:13引用:1難度:0.8 -
3.在一密閉容器內發生氨分解反應:2NH3?N2+3H2。已知NH3起始濃度是2.6mol?L-1,4s末為1.0mol?L-1,若用NH3的濃度變化來表示此反應的速率,則v(NH3)應為( )
A.0.04 mol?L-1?s-1 B.0.4 mol?L-1?s-1 C.1.6 mol?L-1?s-1 D.0.4 mol?L-1?min-1 組卷:161引用:9難度:0.9 -
4.下列措施可使H2的生成速率減小的是( )
A.Na與H2O反應制取H2,增加H2O的用量 B.Mg與H2O反應制取H2,將冷水改為熱水 C.碳粉與H2O(g)反應制取H2,增加碳粉的用量 D.A1與稀硫酸反應制取H2,向稀硫酸中加入K2SO4溶液 組卷:44引用:1難度:0.7 -
5.向一密閉容器中充入1mol N2和3mol H2,在一定條件下發生反應N2+3H2?2NH3,下列有關說法正確的是( )
A.達到化學平衡時,正反應和逆反應的速率都為零 B.當符合3υ正(N2)=υ正(H2)時,反應達到平衡狀態 C.達到化學平衡時,單位時間消耗amolN2,同時生成3amolH2 D.當N2、H2、NH3的分子數比為1:3:2,反應達到平衡狀態 組卷:37引用:10難度:0.9 -
6.在1L密閉容器中進行如下反應:X(g)+3Y(g)?2Z(g),達到平衡時X、Y、Z的物質的量分別為0.1mol、0.3mol、0.2mol,保持溫度和容器體積不變時,再向容器中充入X、Y、Z各0.1mol、0.3mol、0.2mol,則下列說法正確的是( )
A.平衡向正反應方向移動 B.化學平衡常數不變,平衡不移動 C.平衡向逆反應方向移動 D.容器內壓強始終保持原來的2倍 組卷:367引用:1難度:0.7 -
7.由下列生產或實驗得出的相應結論不正確的是( )
事實 結論 A 其他條件相同,Na2S2O3 溶液和H2SO4溶液反應,升高溶液的溫度,析出硫沉淀所需時間縮短 當其他條件不變時,升高反應溫度,化學反應速率加快 B 工業合成氨,在400~500℃比室溫更適合合成氨的反應 升高溫度提高平衡轉化率 C 在容積可變的密閉容器中發生反應:2NH3(g)?N2H4(l)+H2(g),把容積的體積縮小一半 正、逆反應速率均加快 D 向A、B兩支試管中分別加入等體積5%的H2O2溶液,在B試管中加入2~3滴FeCl3溶液,B試管中產生氣泡快 當其他條件不變時,催化劑可以改變化學反應速率 A.A B.B C.C D.D 組卷:15引用:1難度:0.5 -
8.下列說法正確的是( )
A.吸熱反應不可以自發進行 B.同種物質固態時,熵值最大 C.能夠自發進行的反應一定是熵增的過程 D.鐵在潮濕的空氣中生銹的過程是自發的 組卷:87引用:2難度:0.7
二、填空題
-
23.合成氨對人類的生存和發展有著重要意義,1909年哈伯在實驗室中首次利用氮氣與氫氣反應合成氨,實現了人工固氮。
(1)反應N2(g)+3H2(g)?2NH3(g)的化學平衡常數表達式為。
(2)請結合下列數據分析,工業上選用氮氣與氫氣反應固氮,而沒有選用氮氣和氧氣反應固氮的原因是。
(3)對于反應N2(g)+3H2(g)?2NH3(g)在一定條件下氨的平衡含量如下表。序號 化學反應 K(298K)的數值 ① N2(g)+O2(g)?2NO(g) 5×10-31 ② N2(g)+3H2(g)?2NH3(g) 4.1×106
①該反應為溫度/°C 壓強MPa 氨的平衡含量 200 10 81.5% 550 10 8.25% (填“吸熱”或“放熱”)反應。
②其他條件不變時,溫度升高氨的平衡含量減小的原因是(填字母序號)。
A.溫度升高,正反應速率減小,逆反應速率增大,平衡逆向移動
B.溫度升高,K變小。平衡逆向移動
C.溫度升高,活化分子數增多,反應速率加快
(4)在合成氨工業中,原料氣(N2、H2及少量CO、NH3混合氣)在進入合成塔前需經過銅氨液處理,目的是除去其中的CO,其反應為:[Cu(NH3)2]++CO+NH3?[Cu(NH3)3CO]+ΔH<0,則利用銅氨液吸收CO適宜的生產條件是。
(5)科學家持續探索,尋求合成氨的新路徑。如圖為電解法合成氨的原理示意圖,陰極的電極反應式為。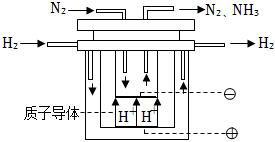 組卷:55引用:1難度:0.7
組卷:55引用:1難度:0.7 -
24.常溫下,有0.1mol/L的四種溶液:①HCl②CH3COOH③NaOH④Na2CO3。
回答下列問題:
(1)用化學方程式解釋溶液②呈酸性的原因:。
(2)將0.1L溶液③加水稀釋至1L后溶液的pH=。
(3)等體積的溶液①、②分別與一定量的溶液③反應,所得溶液的pH均等于7,消耗溶液③的體積:
①②(填“>”、“<”或“=”)。
(4)溶液④根據碳元素質量守恒,則有如下關系:++=0.1mol/L。
(5)常溫下,下列關于溶液②的判斷正確的是。
A.c(CH3COO-)=0.1mol/L
B.溶液中c(H+)>c(CH3COO-)>c(OH-)
C.加入CH3COONa(s),c(H+)不變
D.滴入NaOH濃溶液,溶液導電性增強組卷:179引用:1難度:0.7


