2022-2023學(xué)年山東省高三(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:每小題只有一個(gè)選項(xiàng)符合題目要求
-
1.化學(xué)與生產(chǎn)、生活、環(huán)保等息息相關(guān)。下列敘述錯(cuò)誤的是( )
A.應(yīng)用放射線同位素發(fā)出的射線進(jìn)行金屬制品探傷 B.汽車(chē)尾氣中的NO和CO可在催化劑作用下迅速變成CO2和N2 C.可利用大理石粉與水混合得到的漿狀物對(duì)燃煤產(chǎn)生的廢氣進(jìn)行脫硫處理 D.誤服可溶性鋇鹽后應(yīng)盡快用5%的CuSO4溶液洗胃 組卷:35引用:4難度:0.5 -
2.下列生產(chǎn)過(guò)程不涉及氧化還原反應(yīng)的是( )
A.高爐煉鐵 B.工業(yè)制硫酸 C.用NH3、CO2和飽和食鹽水制備純堿 D.海水提溴 組卷:48引用:6難度:0.7 -
3.下列物質(zhì)的應(yīng)用過(guò)程中不涉及鹽類(lèi)水解的是( )
A.小蘇打用作食品膨松劑 B.硫酸鋁鉀作凈水劑 C.熱堿水清洗廚房里的油污 D.NaH2PO4-Na2HPO4組成pH為7.5的緩沖溶液 組卷:22引用:3難度:0.7 -
4.下列實(shí)驗(yàn)對(duì)應(yīng)的結(jié)論錯(cuò)誤的是( )
A.向品紅溶液中通入二氧化硫氣體,品紅溶液褪色,證明二氧化硫具有漂白性 B.向常溫下的濃硫酸中加入銅片,無(wú)明顯現(xiàn)象,證明濃硫酸使銅片鈍化 C.向KSCN和FeSO4混合溶液中滴加氯水,溶液變成紅色,證明氯水具有氧化性 D.NH3通過(guò)灼熱的CuO,黑色固體逐漸變?yōu)榧t色,證明NH3具有還原性 組卷:45引用:5難度:0.7 -
5.下列實(shí)驗(yàn)中,所選用的實(shí)驗(yàn)儀器(夾持裝置略)能完成相應(yīng)實(shí)驗(yàn)的是( )
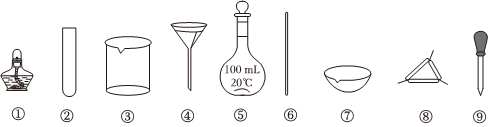
A.灼燒干海帶:選用①、⑦ B.除去BaSO4中的少量BaCO3:選用③、④和⑥ C.配制100mL0.1mol?L-1的NaOH溶液:選用③、⑤、⑥ D.NaCl溶液的蒸發(fā)結(jié)晶:選用①、⑦和⑧ 組卷:26引用:5難度:0.5 -
6.下列說(shuō)法錯(cuò)誤的是( )
A.Mg、Fe在一定條件下都能與水反應(yīng)生成H2和相應(yīng)的堿 B.稀硫酸中加入銅粉,銅粉不溶解,若再繼續(xù)加入KNO3固體,銅粉會(huì)溶解 C.已知Na3N與鹽酸反應(yīng)生成NaCl和NH4Cl,則Mg3N2與鹽酸反應(yīng)生成MgCl2和NH4Cl D.25℃時(shí),100mLpH為10的Na2CO3溶液中水電離出H+的物質(zhì)的量為1.0×10-5mol 組卷:18引用:4難度:0.7
三、非選擇題
-
19.鋨酸鉀晶體(K2OsO4?2H2O)微溶于冷水,常用作催化劑。由含鋨約1g?L-1的鋨吸收液(主要成分為Na2OsO4,含少量Na2RuO4及Ca2+、Mg2+雜質(zhì))精制提純鋨酸鉀的工業(yè)流程如圖:
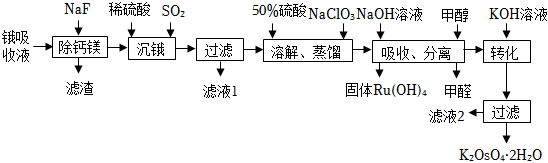
已知:四氧化鋨(OsO4)的熔點(diǎn)為41℃,沸點(diǎn)為130℃,易揮發(fā)
回答下列問(wèn)題:
(1)“沉鋨”得到難溶物(Na2O)3OsO3(SO2)4?5H2O,該化合物中鋨元素的化合價(jià)為。
(2)檢驗(yàn)濾液1和濾液2中金屬陽(yáng)離子的實(shí)驗(yàn)方法是。
(3)“溶解、蒸餾”步驟中,先加入50%硫酸得到Na2OsO4溶液,再加入NaClO3反應(yīng)后蒸餾出OsO4,生成OsO4的離子反應(yīng)方程式為。
(4)OsO4用NaOH溶液吸收后又得到Na2OsO4溶液,吸收液中仍然存在少量Na2RuO4雜質(zhì),“吸收、分離”操作加入甲醇的目的是。流程中從初始的鋨吸收液到“吸收、分離”操作的目的是。
(5)“轉(zhuǎn)化”時(shí)須加入過(guò)量KOH溶液,用平衡原理解釋其原因。
(6)已知:Ksp(MgF2)=9×10-9、Ksp(CaF2)=1.5×10-10。鋨吸收液中Ca2+、Mg2+濃度分別為0.02mol?L-1和0.01mol?L-1,若取1.0L廢液,則至少需加入gNaF才能使廢液中Ca2+、Mg2+沉淀完全(當(dāng)離子濃度c≤1×10-5mol?L-1,可認(rèn)為沉淀完全)。組卷:30引用:3難度:0.3 -
20.落實(shí)“雙碳”目標(biāo),發(fā)展綠色能源,首先是對(duì)氫能源的開(kāi)發(fā)利用。利用甲烷制氫是當(dāng)前研究的熱點(diǎn)。涉及的反應(yīng)如下:
反應(yīng)Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
反應(yīng)Ⅱ:CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH2=+165kJ?mol-1
反應(yīng)Ⅲ:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH3=-41kJ?mol-1
回答下列問(wèn)題:
(1)反應(yīng)Ⅰ的活化能為240.1kJ?mol-1,反應(yīng)Ⅰ逆反應(yīng)的活化能為kJ?mol-1。研究發(fā)現(xiàn),以單一負(fù)載型Ni催化反應(yīng)Ⅰ時(shí),反應(yīng)Ⅰ的逆反應(yīng)在催化劑表面存在兩種活性中心,分別以“*”和“#”表示,在活性位“*”上發(fā)生CO吸附,在活性位“#”上被吸附的CO發(fā)生分解反應(yīng)生成表面碳,表面碳再與H2結(jié)合生成CH4,其催化反應(yīng)機(jī)理的反應(yīng)式如下:
ⅰ.CO+*?CO*快速平衡
ⅱ.CO*+?#O*+C#慢反應(yīng)
ⅲ.C#+2H2?CH4+#快反應(yīng)
ⅳ.快反應(yīng)
反應(yīng)ⅳ的反應(yīng)式為;反應(yīng)Ⅰ逆反應(yīng)的決速步驟是(填反應(yīng)序號(hào))。
(2)T℃時(shí),在某密閉容器中通入一定量的CH4(g)和H2O(g),加入金屬鎳做催化劑,在一定溫度下發(fā)生上述反應(yīng)。
①為提高CH4(g)的平衡轉(zhuǎn)化率,除改變溫度外,還可以采取的措施是。
②恒溫恒容條件下,起始時(shí)CH4(g)和H2O(g)的濃度分別為amol?L-1和bmol?L-1,達(dá)平衡時(shí)CO和CO2的濃度分別為cmol?L-1和dmol?L-1。達(dá)平衡時(shí),H2O的濃度是mol?L-1,反應(yīng)Ⅰ的平衡常數(shù)K是。(用含a、b、c、d的代數(shù)式表示)
③在該溫度下,反應(yīng)Ⅲ的標(biāo)準(zhǔn)平衡常數(shù)Kθ=。[已知:分壓=總壓×該組分物質(zhì)的量分?jǐn)?shù),對(duì)于反應(yīng)dD(g)+eE(g)?gG(g)+hH(g),Kθ=,其中pθ=100kPa,pG、pH、pD、pE為各組分的平衡分壓](pGpθ)g?(pHpθ)h(pDpθ)d?(pEpθ)e
(3)在某一給定進(jìn)料比的情況下,溫度、壓強(qiáng)對(duì)平衡體系中H2物質(zhì)的量分?jǐn)?shù)的影響如圖: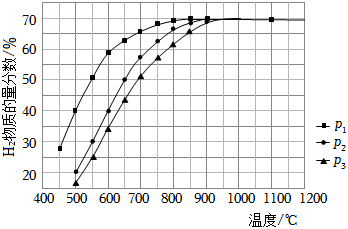
壓強(qiáng)由大到小的順序?yàn)?,體系溫度未達(dá)到400℃時(shí),H2物質(zhì)的量分?jǐn)?shù)幾乎為0的原因是。組卷:26引用:3難度:0.7


