2021-2022學(xué)年湖北省部分名校聯(lián)考高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),下列說(shuō)法錯(cuò)誤的是( )
A.葡萄酒中添加適量SO2,可起到漂白和抗氧化的效果 B.燃煤中加入生石灰只能減少酸雨的產(chǎn)生,不能減少溫室氣體的排放 C.硅膠可用作食品的干燥劑 D.碳酸氫鈉是治療胃酸過多的一種藥劑 組卷:2引用:1難度:0.7 -
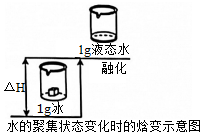 2.下列反應(yīng)的能量變化與示意圖不相符的是( )
2.下列反應(yīng)的能量變化與示意圖不相符的是( )A.鹽酸和碳酸氫鈉的反應(yīng) B.灼熱的炭與水蒸氣的反應(yīng) C.生石灰與水的反應(yīng) D.氫氧化鋇與氯化銨的反應(yīng) 組卷:15引用:5難度:0.9 -
3.下列有關(guān)電解質(zhì)的說(shuō)法正確的是( )
A.碳酸氫鋇是強(qiáng)電解質(zhì) B.乙醇是弱電解質(zhì) C.石墨能導(dǎo)電,所以石墨是電解質(zhì) D.食鹽水能導(dǎo)電,所以食鹽水是電解質(zhì) 組卷:26引用:4難度:0.6 -
4.常溫下,下列電解質(zhì)在水中電離的電離方程式正確的是( )
A.HF?H++F- B.H2S?2H++S2- C.Ca(HCO3)2?Ca2++2HCO3- D.K2SO3?SO32-+2K+ 組卷:48引用:8難度:0.7 -
5.下列說(shuō)法正確的是( )
A.用稀鹽酸與塊狀大理石反應(yīng)生成CO2時(shí),為了加快反應(yīng)速率,可以將塊狀大理石換成等質(zhì)量的粉末狀大理石 B.對(duì)于反應(yīng)H2(g)+I2(g)?2HI(g)的平衡體系,增大壓強(qiáng),平衡常數(shù)增大 C.Fe和S在加熱條件下反應(yīng)生成FeS,所以Cu和S在加熱條件下反應(yīng)也生成CuS D.金屬Na可以保存在煤油中,所以金屬Li也可以保存在煤油中 組卷:8引用:5難度:0.6 -
6.在10L恒容密閉容器中通入1molN2和3molH2,一定條件下發(fā)生反應(yīng):N2(g)+3H2(g)?2NH3(g)。3min時(shí)測(cè)得生成1.8molNH3,則0~3min內(nèi)H2的平均反應(yīng)速率為( )
A.0.03mol?L-1?min-1 B.0.06mol?L-1?min-1 C.0.09mol?L-1?min-1 D.0.27mol?L-1?min-1 組卷:17引用:4難度:0.7
二、非選擇題:本題共4小題,共55分。
-
 18.生活中常用到酸和堿,請(qǐng)結(jié)合所學(xué)的相關(guān)知識(shí)回答下列問題:
18.生活中常用到酸和堿,請(qǐng)結(jié)合所學(xué)的相關(guān)知識(shí)回答下列問題:
已知:25℃時(shí),CH3COOH的Ka=1.6×10-5,NH3?H2O的Kb=1.6×10-5。
(1)冰醋酸加水稀釋過程中溶液的導(dǎo)電能力變化趨勢(shì)圖如圖所示。
①加水前冰醋酸的導(dǎo)電能力幾乎為零,原因是。
②a、b、c三點(diǎn)所對(duì)應(yīng)的溶液中,n(H+)由小到大的順序是(用a、b、c表示)。
③c點(diǎn)對(duì)應(yīng)的溶液中,所含微粒的種類共有種。
(2)常溫下,在0.1mol?L-1的CH3COOH溶液和0.1mol?L-1的NH3?H2O溶液中:
①0.1mol?L-1的CH3COOH溶液中c(H+)=mol?L-1;0.1mol?L-1的NH3?H2O溶液中c(H+)=mol?L-1。
②0.1mol?L-1的CH3COOH溶液中水的電離程度(填“大于”、“小于”或“等于”)0.1mol?L-1的NH3?H2O溶液中水的電離程度,兩種溶液混合時(shí)發(fā)生反應(yīng)的離子方程式為。
(3)常溫下,下列說(shuō)法正確的是(填標(biāo)號(hào))。
a.向CH3COOH溶液中不斷加水稀釋的過程中,的值逐漸減小c(CH3COO-)c(CH3COOH)
b.0.1mol?L-1的NH3?H2O溶液與0.2mol?L-1的NH3?H2O溶液中,Kb的值相同
c.常溫下,將10mL0.1mol?L-1NH3?H2O溶液加水稀釋至10L后,的值減小c(NH4+)?c(OH-)c(NH3?H2O)
d.CH3COOH溶液和NH3?H2O溶液的導(dǎo)電能力不一定相同組卷:34引用:5難度:0.5 -
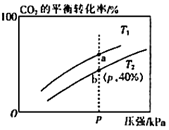 19.在某一恒壓的密閉容器中,充入一定量的H2和CO2發(fā)生反應(yīng):CO2(g)+3H2(g)?CH3OH (g)+H2O(g) ΔH。實(shí)驗(yàn)測(cè)得在不同溫度下,反應(yīng)體系中CO2的平衡轉(zhuǎn)化率與壓強(qiáng)的關(guān)系如圖所示。回答下列問題:
19.在某一恒壓的密閉容器中,充入一定量的H2和CO2發(fā)生反應(yīng):CO2(g)+3H2(g)?CH3OH (g)+H2O(g) ΔH。實(shí)驗(yàn)測(cè)得在不同溫度下,反應(yīng)體系中CO2的平衡轉(zhuǎn)化率與壓強(qiáng)的關(guān)系如圖所示。回答下列問題:
(1)經(jīng)測(cè)得,每生成0.5molH2O(g)時(shí),反應(yīng)放出的熱量為24.5kJ,則ΔH=。
(2)(填“高溫”或“低溫”)有利于該反應(yīng)自發(fā)進(jìn)行,判斷的理由是。
(3)判斷平衡常數(shù)Ka與Kb的大小關(guān)系:KaKb(填“<”、“>”或“=”)。
(4)在T2和p的條件下,往該容器中充入1.5molH2和0.5molCO2,該反應(yīng)在第5min時(shí)達(dá)到平衡,此時(shí)容器的體積為2L。
①反應(yīng)達(dá)到平衡時(shí),c(CH3OH)=mol?L-1,H2O(g)的物質(zhì)的量分?jǐn)?shù)為%。
②該反應(yīng)在此溫度下的平衡常數(shù)為(保留兩位有效數(shù)字)。
③反應(yīng)達(dá)到平衡后,保持其他條件不變,再往該容器中充入0.1molH2和0.1molH2O(g),此時(shí)平衡(填“向正反應(yīng)方向”、“向逆反應(yīng)方向”或“不”)移動(dòng)。組卷:5引用:1難度:0.5


