2020-2021學年四川省達州市高二(上)期末化學試卷
發布:2024/11/12 13:30:2
一、選擇題(共21小題,每小題2分,滿分42分)
-
1.下列屬于可再生能源的是( )
A.氫能 B.石油 C.煤 D.天然氣 組卷:19引用:5難度:0.7 -
2.下列化學變化中,屬于吸熱反應的是( )
A.鋅粒與稀硫酸的反應 B.Ba(OH)2?8H2O與NH4Cl晶體的反應 C.甲烷在空氣中燃燒 D.Na與H2O反應 組卷:5引用:2難度:0.8 -
3.已知:CH3COOH(aq)?H+(aq)+CH3COO-(aq)ΔH1>0;HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)ΔH2;CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1)ΔH3,下列關系正確的是( )
A.ΔH1<ΔH2 B.ΔH2<ΔH3 C.ΔH2=ΔH3 D.ΔH2>ΔH3 組卷:3引用:1難度:0.5 -
 4.如圖所示,下列熱化學方程式正確的是( )
4.如圖所示,下列熱化學方程式正確的是( )A.2H2(g)+O2(g)=2H2O(g)ΔH=2(a+b)kJ?mol-1 B.2H2(g)+O2(g)=2H2O(g)ΔH=2(b-a)kJ?mol-1 C.2H2(g)+O2(g)=2H2O(1)ΔH=2(b-a+c)kJ?mol-1 D.2H2(g)+O2(g)=2H2O(1)ΔH=2(a-b-c)kJ?mol-1 組卷:13引用:2難度:0.5 -
5.下列能層中,有9個原子軌道的是( )
A.K B.L C.M D.N 組卷:10引用:2難度:0.9 -
6.下列各項敘述中不正確的是( )
A.同一原子能層越高,s電子云半徑越大 B.同一能層運動的電子,其自旋方向可能不同 C.雜化軌道用于形成σ鍵和容納孤電子對 D.鎂原子的核外電子排布由1s22s22p63s2→1s22s22p63p2時,釋放能量 組卷:12引用:2難度:0.8 -
7.下列物質中,含有共價鍵的離子晶體是( )
A.Br2 B.Na2O2 C.CO2 D.MgCl2 組卷:19引用:2難度:0.9 -
8.下列有關化學用語不正確的是( )
A.基態 Ti原子的電子排布式:1s22s22p63s23p63d24s21822B.已知NH5是離子化合物,其電子式為: 
C.35Cl-的離子結構示意圖為 
D.基態C原子的電子排布圖為  組卷:9引用:1難度:0.8
組卷:9引用:1難度:0.8
二、解答題(共4小題,滿分58分)
-
24.甲、乙兩小組分別設計實驗探究影響化學反應速率的因素。回答下列問題:
Ⅰ.甲組同學設計實驗定量探究不同催化劑對化學反應速率的影響。裝置如圖1所示,錐形瓶中盛有足量的濃度相同的H2O2溶液。實驗記錄如下:
(1)實驗時檢查該裝置氣密性的方法是分別向錐形瓶中加入的試劑 相同條件下收集到的氣體體積 反應時間 反應速率 1mL0.1mol/LFeCl3溶液 20mL t1 v1 1mL0.1mol/LCuCl2溶液 20mL t2 v2 。
(2)加入FeCl3溶液時錐形瓶中發生反應的化學方程式。
(3)若t1<t2,則v1v2,由此得出的結論是。
(4)利用本裝置還可以通過測定,從而確定不同催化劑對H2O2分解的催化效果。
Ⅱ.乙組同學按照如圖2所示的實驗裝置探究外界條件對化學反應速率的影響。化學試劑有:硫代硫酸鈉(Na2S2O3)溶液與稀硫酸。通過A、B裝置(加熱儀器和夾持儀器均已省略),進行了三組實驗,數據記錄如下:
(5)實驗時發生反應的離子方程式為實驗組號 溫度 溶液 加入 的體積 出現沉淀所需時間/s 體積 濃度/ 體積 濃度 Ⅰ 0℃ 5mL 10 5mL 8 Ⅱ 0℃ 5mL 5 10mL 12 Ⅲ 30℃ 5mL 5 10mL 4 。
(6)探究溫度對反應速率影響時,選擇的對比實驗是(選填Ⅰ、Ⅱ、Ⅲ),由Ⅰ與Ⅱ兩組數據得出的結論是。組卷:4引用:1難度:0.5 -
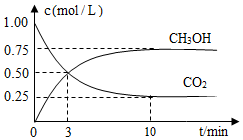 25.工業上利用反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH可減少CO2的排放。
25.工業上利用反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH可減少CO2的排放。
(1)已知:CO2(g)+H2(g)?H2O(g)+CO2(g) ΔH1=+41.0kJ?mol-1。CO2(g)+H2(g)?CH3OH(g)ΔH2=-90.0kJ?mol-1 ΔH=。
(2)工業上為提高CH3OH產率,理論上應采用的條件是(填字母)。
A.高溫高壓
B.低溫低壓
C.高溫低壓
D.低溫高壓
(3)能判斷工業上合成甲醇反應達到化學平衡狀態的依據是(填字母)。
A.容器內壓強不變
B.混合氣體中c(CO2)不變
C.v(CH3OH)=v(H2O)
D.c(CH3OH)=c(H2O)
(4)在容積為1L的恒溫密閉容器中充入1molCO2和3molH2,一定條件下發生反應,測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
①0~3minv(H2O)=(保留兩位小數)。
②H2的平衡轉化率是%。
③平衡常數K=(保留兩位小數)。
(5)催化劑和反應條件與反應物轉化率和產物的選擇性有高度相關。控制相同投料比和相同反應時間,四組實驗數據如下:
(注:甲醇選擇性是指轉化的CO2中生成甲醇的百分含量),根據上表所給數據,用CO2生產甲醇的最優選項為實驗編號 溫度(K) 催化劑 CO2轉化率(%) 甲醇選擇性(%) A 543 Cu/ZnO納米棒 12.3 42.3 B 543 Cu/ZnO納米片 11.9 72.7 C 553 Cu/ZnO納米棒 15.3 39.1 D 553 Cu/ZnO納米片 12.0 70.6 (填字母)。組卷:7引用:1難度:0.4


